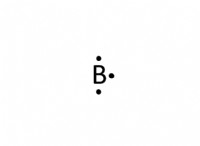Ποιος είναι ο ρόλος που διαδραματίζουν τα ηλεκτρόνια σθένους στο σχηματισμό ομολόγων;
1. Επίτευξη σταθερότητας:
* Τα άτομα προσπαθούν για μια σταθερή διαμόρφωση ηλεκτρονίων, που συχνά μοιάζουν με τα ευγενή αέρια με το πλήρες εξώταξο κέλυφος τους.
* Τα ηλεκτρόνια σθένους εμπλέκονται στην επίτευξη αυτής της σταθερότητας, κερδίζοντας, απώλεια ή κοινή χρήση ηλεκτρονίων.
2. Τύποι ομολόγων:
* Ιονικά ομόλογα: Άτομα με μεγάλη διαφορά στην ηλεκτροαρνητικότητα (τάση να προσελκύουν ηλεκτρόνια) ηλεκτρόνια σθένους. Αυτό δημιουργεί ιόντα με αντίθετες χρεώσεις, οι οποίες προσελκύουν ο ένας τον άλλον. Παράδειγμα:Το νάτριο (Na) χάνει ένα ηλεκτρόνιο σθένους στο χλώριο (CL) για να σχηματίσει Na+ και Cl-ions, σχηματίζοντας NaCl (τραπέζι αλάτι).
* ομοιοπολικοί δεσμοί: Άτομα με παρόμοια ηλεκτροαρνητικά ηλεκτρόνια μερίδιο σθένους για την επίτευξη σταθερής διαμόρφωσης ηλεκτρονίων. Παράδειγμα:Δύο άτομα υδρογόνου μοιράζονται το ηλεκτρόνιο του ενιαίου σθένους για να σχηματίσουν ένα σταθερό μόριο Η2.
* Μεταλλικοί δεσμοί: Τα ηλεκτρόνια σθένους απομακρύνονται (ελεύθερα για κίνηση) σε όλο το πλέγμα των ατόμων μετάλλων. Αυτό δημιουργεί μια "θάλασσα ηλεκτρονίων" που συγκρατεί τα μέταλλα άτομα μαζί.
3. Ιδιότητες δεσμών:
* Αντοχή δεσμού: Ο αριθμός των ηλεκτρόνων σθένους που εμπλέκονται στη συγκόλληση και ο τύπος του δεσμού επηρεάζουν τη δύναμη του δεσμού. Περισσότερα ηλεκτρόνια σθένους οδηγούν γενικά σε ισχυρότερους δεσμούς.
* Πόλη Bond: Η διαφορά στην ηλεκτροαρνητικότητα μεταξύ των ατόμων που μοιράζονται ηλεκτρόνια καθορίζει την πολικότητα του δεσμού. Μια μεγαλύτερη διαφορά οδηγεί σε έναν πιο πολικό δεσμό.
Συνοπτικά: Τα ηλεκτρόνια σθένους είναι οι βασικοί παράγοντες της χημικής σύνδεσης. Υπαγορεύουν τον τρόπο αλληλεπίδρασης των ατόμων, οδηγώντας στο σχηματισμό σταθερών μορίων και στη συντριπτική ποικιλία των χημικών ενώσεων που βλέπουμε στον κόσμο.