Τι προκαλεί το άτομο να αντιδράσει μεταξύ τους;
1. Ο κανόνας οκτάδων:
* Τα άτομα είναι πιο σταθερά όταν έχουν ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων. Αυτό σημαίνει συνήθως να έχουν οκτώ ηλεκτρόνια (ο "κανόνας οκτάδων").
* Τα άτομα με ελλιπή εξωτερικά κελύφη τείνουν να είναι αντιδραστικά, προσπαθώντας να κερδίσουν, να χάσουν ή να μοιραστούν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση.
2. Ηλεκτροαρνητικότητα:
* Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια.
* Τα άτομα με υψηλή ηλεκτροαρνητικότητα είναι πιο πιθανό να προσελκύσουν ηλεκτρόνια από άλλα άτομα, σχηματίζοντας δεσμούς.
3. Τύποι χημικών δεσμών:
* Ιονικά ομόλογα: Ένα άτομο χάνει ηλεκτρόνια σε ένα άλλο, δημιουργώντας φορτισμένα ιόντα που προσελκύουν ο ένας τον άλλον. Αυτό συμβαίνει όταν υπάρχει σημαντική διαφορά στην ηλεκτροαρνητικότητα. (π.χ., NaCl - χλωριούχο νάτριο)
* ομοιοπολικοί δεσμοί: Τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν ένα σταθερό εξωτερικό κέλυφος. Αυτό συμβαίνει όταν η ηλεκτροαρνητικότητα είναι παρόμοια. (π.χ., H₂o - νερό)
* Μεταλλικοί δεσμοί: Τα ηλεκτρόνια απομακρύνονται και μοιράζονται σε μια "θάλασσα" ηλεκτρονίων σε μεταλλικό πλέγμα.
4. Παράγοντες που επηρεάζουν την αντιδραστικότητα:
* Αριθμός ηλεκτρονίων σθένους: Τα άτομα με λιγότερα ηλεκτρόνια σθένους (ηλεκτρόνια στο εξωτερικό κέλυφος) είναι πιο αντιδραστικά.
* Μέγεθος του ατόμου: Τα μικρότερα άτομα έχουν περισσότερη συμπυκνωμένη πυκνότητα ηλεκτρονίων, καθιστώντας τα πιο αντιδραστικά.
* ενέργεια ιονισμού: Η ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα άτομο. Η χαμηλότερη ενέργεια ιονισμού σημαίνει ότι το άτομο είναι πιο πιθανό να χάσει ένα ηλεκτρόνιο και να γίνει αντιδραστικό.
* συγγένεια ηλεκτρονίων: Η μεταβολή της ενέργειας όταν ένα ηλεκτρόνιο προστίθεται σε ένα άτομο. Η υψηλότερη συγγένεια ηλεκτρονίων σημαίνει ότι το άτομο είναι πιο πιθανό να κερδίσει ένα ηλεκτρόνιο και να γίνει αντιδραστική.
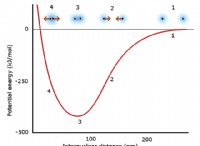
5. Αντιδράσεις και ενεργειακές αλλαγές:
* Οι χημικές αντιδράσεις περιλαμβάνουν το σπάσιμο και το σχηματισμό χημικών δεσμών.
* Ορισμένες αντιδράσεις απελευθερώνουν ενέργεια (εξωθερμική) και μερικές απαιτούν ενέργεια (ενδοθερμική).
* Η συνολική ενεργειακή αλλαγή μιας αντίδρασης καθορίζεται από τη δύναμη των δεσμών που σχηματίζονται και σπάζουν.
Συνοπτικά:
Τα άτομα αντιδρούν για να επιτύχουν μια πιο σταθερή ηλεκτρονική διαμόρφωση. Αυτό μπορεί να συμβεί μέσω του σχηματισμού διαφορετικών τύπων χημικών δεσμών. Παράγοντες όπως η ηλεκτροαρνητικότητα, η ενέργεια ιονισμού και η συγγένεια ηλεκτρονίων επηρεάζουν την αντιδραστικότητα των ατόμων.