Μοριακή Τροχιακή Θεωρία
Βασικές έννοιες
Σε αυτό το άρθρο, μαθαίνουμε για τη Μοριακή Τροχιακή Θεωρία, μια σημαντική έννοια στην κβαντομηχανική, καθώς και για την εφαρμογή της στην κατανόηση των μοριακών δεσμών και των αντιδεσμών.
Θέματα που καλύπτονται σε άλλα άρθρα
- Κβαντικοί αριθμοί και τροχιακά σχήματα
- Αρχή αποκλεισμού Pauli
- Αρχή Aufbau
- Κελύφη ηλεκτρονίων
- Οξυγόνο:Το πιο ευέλικτο στοιχείο
Τι είναι η Μοριακή Τροχιακή Θεωρία;
Η μοριακή τροχιακή θεωρία (MOT) είναι μία από τις δύο θεμελιώδεις θεωρίες δεσμών, μαζί με τη θεωρία του δεσμού σθένους (VBT), που βοηθούν στην εξήγηση του σχηματισμού δεσμών μεταξύ των ατόμων. Συγκεκριμένα, η μοριακή τροχιακή θεωρία είναι χρήσιμη για να εξηγήσει πώς ο δεσμός αλλάζει χημικά την ατομική συμπεριφορά. Επιπλέον, η θεωρία εξηγεί φαινόμενα που δεν εξηγούνται από τη θεωρία του δεσμού σθένους, όπως η παραμαγνητική φύση του διατομικού οξυγόνου
Στην πιο βασική της θεωρία, η μοριακή τροχιακή θεωρία δηλώνει ότι ο σχηματισμός δεσμών περιλαμβάνει την ανάμειξη τροχιακών ατομικού σθένους για να σχηματιστούν μοριακά τροχιακά. Αυτό διαφέρει από τη θεωρία του δεσμού σθένους, η οποία λέει ότι οι δεσμοί σχηματίζονται από ηλεκτρόνια κοινού σθένους που παραμένουν στα ατομικά τροχιακά τους
Σχηματισμός μοριακού τροχιακού
Στην ουσία, ένας χημικός δεσμός περιλαμβάνει τους πυρήνες δύο ατόμων που έλκονται το ένα από τα ηλεκτρόνια του άλλου. Καθώς δύο πυρήνες πλησιάζουν ο ένας τον άλλον, αυτή η ελκτική δύναμη αυξάνεται. Ωστόσο, τα δύο άτομα απωθούν όλο και περισσότερο το ένα το άλλο σε μικρότερες αποστάσεις, λόγω των όμοιων φορτίων των πυρήνων και των ηλεκτρονίων. Τελικά, υπάρχει κάποια απόσταση όπου τα άτομα έλκονται περισσότερο μεταξύ τους πριν οι απωστικές δυνάμεις κυριαρχήσουν στην αλληλεπίδραση. Όταν δύο άτομα φτάσουν σε αυτή την τέλεια ελκυστική απόσταση, θεωρούνται χημικά συνδεδεμένα. Αυτή η απόσταση συμβολίζεται με το ελάχιστο (3) στο παρακάτω γράφημα:
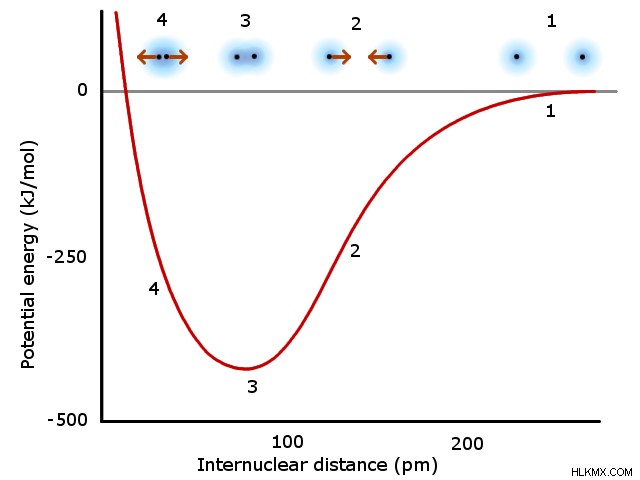
Σύμφωνα με τη θεωρία των μοριακών τροχιακών, τα τροχιακά σθένους και των δύο ατόμων αναμιγνύονται για να σχηματίσουν μοριακά τροχιακά. Καθώς τα ηλεκτρόνια σθένους γεμίζουν αυτά τα νέα μοριακά τροχιακά, κατά συνέπεια συμπεριφέρονται διαφορετικά από ότι όταν καταλαμβάνουν ατομικά τροχιακά. Έτσι, ο δεσμός σύμφωνα με τη θεωρία των μοριακών τροχιακών αλλάζει εγγενώς τη χημική συμπεριφορά των εμπλεκόμενων ατόμων.

Σύμφωνα με τους νόμους της κβαντικής μηχανικής, ο αριθμός των τροχιακών σθένους πρέπει να παραμένει σταθερός για κάθε άτομο. Έτσι, αν τα δύο s τροχιακά σθένους δύο υδρογόνων αναμιγνύονται, σχηματίζονται δύο μοριακά τροχιακά:το τροχιακό δέσμευσης σίγμα και το τροχιακό αντιδεσμικό σίγμα. Όταν τα ηλεκτρόνια καταλαμβάνουν το τροχιακό δεσμού, η δυναμική ενέργεια των ατόμων πέφτει καθώς σχηματίζεται ένας δεσμός σίγμα αμοιβαίας έλξης. Αλλά τι ακριβώς είναι ένα αντιδεσμικό τροχιακό;
Ομόλογα και αντιομόλογα
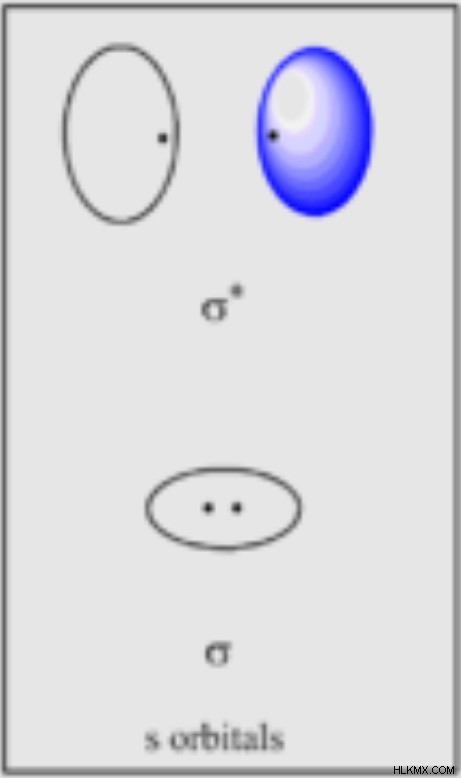
Χωρικά, για να έχουν δύο πυρήνες ελκτικές δυνάμεις μεταξύ των ηλεκτρονίων σθένους, αυτά τα ηλεκτρόνια πρέπει να καταλαμβάνουν κάποιο χώρο μεταξύ των δύο πυρήνων. Αυτός ο χώρος είναι το συνδετικό τροχιακό.
Μπορούμε επίσης να φανταστούμε ότι οι πυρήνες πλησιάζουν με τα ηλεκτρόνια τους να καταλαμβάνουν το χώρο στην άλλη πλευρά των πυρήνων. Σε αυτή την περίπτωση, η έλξη των πυρήνων προς τα ηλεκτρόνια τους απομακρύνει τους πυρήνες ο ένας από τον άλλο, αποτρέποντας έναν δεσμό. Αυτός ο χώρος είναι το αντιδεσμικό τροχιακό.
Επιπλέον, αν θυμόμαστε ότι τα ηλεκτρόνια υπολογίζονται ως κύματα, όπως ο ήχος ή το φως, μπορούμε να σκεφτούμε έναν δεσμό ως μια εποικοδομητική αλληλεπίδραση μεταξύ των κυμάτων των κοινών ηλεκτρονίων. Ο συνδυασμός των ατομικών τροχιακών όταν είναι «σε φάση», που σημαίνει ότι και τα δύο ηλεκτρόνια καταλαμβάνουν το χώρο μεταξύ των πυρήνων, η αλληλεπίδραση ενισχύεται, σχηματίζοντας έναν δεσμό. Ωστόσο, εάν τα ηλεκτρόνια είναι "εκτός φάσης", που σημαίνει ότι και τα δύο δεν καταλαμβάνουν το χώρο μεταξύ των πυρήνων, η αλληλεπίδραση είναι καταστροφική, αποτρέποντας περαιτέρω ελκτικές δυνάμεις μεταξύ των πυρήνων.
Διαφορές μεταξύ της θεωρίας του δεσμού σθένους και της μοριακής τροχιακής θεωρίας
Ο παρακάτω πίνακας συνοψίζει τις διαφορές μεταξύ της θεωρίας του δεσμού σθένους και της θεωρίας των μοριακών τροχιακών.
| Φαινόμενο | Θεωρία δεσμού σθένους | Μοριακή τροχιακή θεωρία |
| Συγκολλητικά τροχιακά | Τα ηλεκτρόνια που εμπλέκονται στον δεσμό παραμένουν σε τροχιακά ατομικού σθένους. | Τα ηλεκτρόνια που εμπλέκονται στη σύνδεση εισέρχονται σε ένα νεοδημιουργημένο τροχιακό μοριακού δεσμού. |
| Ατομική Χημεία | Τα άτομα διατηρούν τη χαρακτηριστική χημική τους φύση. | Τα άτομα αλλάζουν χημικά, λόγω της κίνησης των ηλεκτρονίων τους στα μοριακά τροχιακά. |
| Χρήση ηλεκτρονίων σθένους | Γενικά, δεν εμπλέκονται όλα τα ηλεκτρόνια σθένους ενός ατόμου στον δεσμό. | Όλα τα ηλεκτρόνια σθένους του ατόμου μετατοπίζονται σε τροχιακά μοριακού δεσμού και έτσι το καθένα συμμετέχει στον δεσμό. |
| Συντονισμός | Αναγνωρίζει ότι τα συντονιστικά μόρια είναι χημικά διακριτά. | Δεν λαμβάνει υπόψη τον συντονισμό των μορίων. |
| Μοριακός δεσμός | Λογοδοτεί μόνο τη σχέση σύνδεσης μεταξύ δύο ατόμων κάθε φορά. | Υπολογίζει τη σύνδεση ολόκληρου του μορίου. |
| Υβριδισμός | Ορίζει και χαρακτηρίζει την υβριδοποίηση. | Δεν απεικονίζει υβριδισμό. |
Παραδείγματα δεσμών στη μοριακή τροχιακή θεωρία
Τώρα που καταλαβαίνουμε τόσο τους δεσμούς όσο και τους αντιδεσμούς, ας δούμε μερικά παραδείγματα.
H2 Σχηματισμός Δεσμών
Όταν έχουμε δύο ουδέτερα φορτισμένα υδρογόνα, και τα δύο άτομα ξεχωριστά έχουν ένα ηλεκτρόνιο σθένους στο 1s τροχιάς. Καθώς τα υδρογόνα πλησιάζουν, τα τροχιακά σθένους τους αναμειγνύονται, σχηματίζοντας τα τροχιακά δέσμευσης σίγμα και αντιδεσμικά τροχιακά. Μπορούμε να εκφράσουμε αυτούς τους τροχιακούς σχηματισμούς χρησιμοποιώντας ένα μοριακό τροχιακό διάγραμμα.
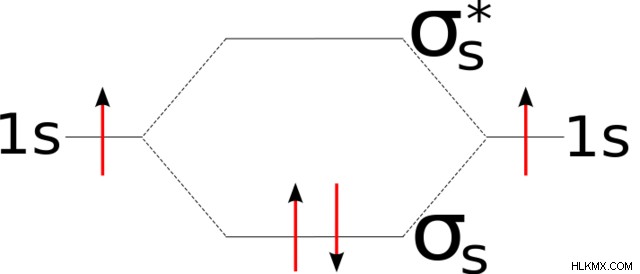
Όπως αναφέρθηκε προηγουμένως, το τροχιακό δεσμού περιλαμβάνει πτώση της δυναμικής ενέργειας. Αντίθετα, η αντιδέσμευση συνεπάγεται αύξηση της δυναμικής ενέργειας, καθώς τα άτομα αντιστέκονται στην προσέγγιση. Το μοριακό τροχιακό διάγραμμα αντανακλά αυτές τις ενεργειακές αλλαγές. Συγκεκριμένα, εμφανίζει τα τροχιακά δέσμευσης σίγμα και αντιδεσμικά τροχιακά αντίστοιχα κάτω και πάνω από τα τροχιακά σθένους.
Επειδή τα άτομα επιδιώκουν να μειώσουν τη δυναμική τους ενέργεια, τα ηλεκτρόνια ενός σθένους γεμίζουν το τροχιακό δεσμού σίγμα, σχηματίζοντας έναν δεσμό.

O2 Σχηματισμός Δεσμών
Με δύο ουδέτερα φορτισμένα οξυγόνα, και τα δύο άτομα έχουν έξι συνολικά ηλεκτρόνια σθένους σε τέσσερα τροχιακά 2s και 2p ενεργειακά επίπεδα. Δεδομένου ότι όλα τα τροχιακά σθένους σχηματίζουν μοριακά τροχιακά, τα οκτώ συνολικά τροχιακά σθένους μεταξύ των δύο μορίων αναμειγνύονται για να σχηματίσουν οκτώ μοριακά τροχιακά. Όπως και με το υδρογόνο, τα 2s τα τροχιακά σχηματίζουν έναν δεσμό σίγμα και ένα τροχιακό αντιδεσμικό σίγμα. Τα δύο σετ των τριών 2p τα τροχιακά σχηματίζουν τα ίδια τροχιακά σίγμα, καθώς και δύο τροχιακά δεσμούς pi και αντιδεσμικά τροχιακά.
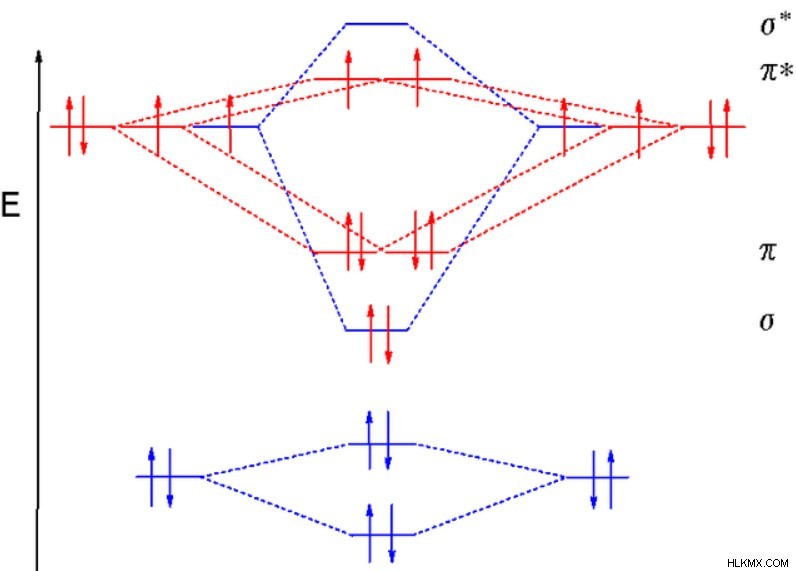
Και τα δύο 2s τα τροχιακά του οξυγόνου συγκρατούν δύο ηλεκτρόνια, τα οποία γεμίζουν τα τροχιακά δεσμών σίγμα και αντιδεσμών. Και τα δύο 2p Τα τροχιακά έχουν τέσσερα ηλεκτρόνια, οκτώ συνολικά μεταξύ των δύο οξυγόνων. Δεδομένου ότι τα τροχιακά χαμηλότερης ενέργειας γεμίζουν πρώτα, τα τροχιακά σίγμα και π γεμίζουν, αφήνοντας δύο ηλεκτρόνια να καταλαμβάνουν τα τροχιακά αντιδεσμού pi. Λόγω του Κανόνα του Hund, τα ηλεκτρόνια καταλαμβάνουν το καθένα ένα ξεχωριστό τροχιακό αντιδέσμευσης.
Συνολικά, O2 έχει δύο δεσμούς σίγμα και ένα αντιδεσμό σίγμα, που συμψηφίζει έναν δεσμό σίγμα. Επιπλέον, το μόριο έχει δύο δεσμούς pi και δύο μισογεμάτους δεσμούς pi, οι οποίοι τελικά συνδέουν έναν δεσμό pi. Με έναν δεσμό σίγμα και έναν δεσμό pi, η θεωρία μοριακών δεσμών προβλέπει ότι το οξυγόνο έχει διπλό δεσμό, σύμφωνο με τη θεωρία του δεσμού σθένους.

Επιπλέον, όπως αναφέρθηκε προηγουμένως, η τοποθέτηση των δύο ηλεκτρονίων στους ξεχωριστούς αντιδεσμούς κάνει το O2 παραμαγνητικός. Μπορείτε να παρατηρήσετε αυτόν τον παραμαγνητισμό όταν ρίχνετε υγρό O2 ανάμεσα στους πόλους ενός ισχυρού μαγνήτη. Ως αποτέλεσμα, το υγρό οξυγόνο παγιδεύεται στο μαγνητικό πεδίο.





