Είναι υδρογονάνθρακες σε διαλυτό νερό;
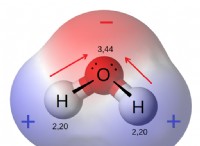
* πολικότητα: Το νερό είναι ένα πολικό μόριο, που σημαίνει ότι έχει ένα θετικό και αρνητικό τέλος λόγω της ανομοιόμορφης κατανομής των ηλεκτρονίων. Οι υδρογονάνθρακες, από την άλλη πλευρά, είναι μη πολικά μόρια, με τα ηλεκτρόνια να μοιράζονται εξίσου μεταξύ ατόμων άνθρακα και υδρογόνου.
* "Όπως διαλύεται όπως": Η αρχή του "όπως διαλύεται όπως" δηλώνει ότι οι ουσίες με παρόμοιες πολικότητες είναι πιο πιθανό να διαλύονται μεταξύ τους. Δεδομένου ότι το νερό είναι πολικοί και οι υδρογονάνθρακες είναι μη πολικοί, δεν αναμειγνύονται καλά.
* Διαμοριακές δυνάμεις: Τα μόρια νερού σχηματίζουν ισχυρούς δεσμούς υδρογόνου μεταξύ τους. Οι υδρογονάνθρακες έχουν κυρίως αδύναμες δυνάμεις van der Waals. Η διαφορά στις διαμοριακές δυνάμεις καθιστά δύσκολο για τους υδρογονανθράκους να διαταράξουν το ισχυρό δίκτυο συγκόλλησης υδρογόνου στο νερό.
Εξαιρέσεις:
* υδρογονάνθρακες βραχείας αλυσίδας: Πολύ μικροί υδρογονάνθρακες, όπως το μεθάνιο (CH4) και το αιθάνιο (C2H6), έχουν κάποια περιορισμένη διαλυτότητα στο νερό. Αυτό οφείλεται στο γεγονός ότι το μικρό τους μέγεθος επιτρέπει να αλληλεπιδρούν ασθενώς με μόρια νερού.
* υδρογονάνθρακες με λειτουργικές ομάδες: Εάν ένα μόριο υδρογονανθράκων έχει πολική λειτουργική ομάδα, όπως αλκοόλ (-ΟΗ) ή καρβοξυλικό οξύ (-COOH), μπορεί να έχει αυξήσει τη διαλυτότητα στο νερό.
Συνοπτικά: Οι υδρογονάνθρακες είναι γενικά αδιάλυτοι στο νερό λόγω της μη πολικής φύσης τους και των διαφορών στις διαμοριακές δυνάμεις μεταξύ τους και του νερού.