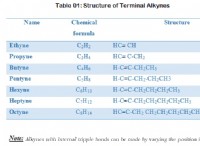
Τι μπορεί να προστεθεί σε μια λύση των ιόντων Cu2 (aq) Mg2 και Sr2, καθίζοντας τα αλλά όχι άλλα;
Κατανόηση της διαλυτότητας
* ιωδιούχο χαλκού (II) (CUI): Ο χαλκός (i) ιωδίδιο (CUI) είναι πολύ αδιάλυτο στο νερό. Αυτός είναι ένας βασικός παράγοντας στη λύση μας.
* ιωδιούχο μαγνησίου (MGI₂): Το ιωδιούχο μαγνησίου είναι εξαιρετικά διαλυτό στο νερό.
* ιωδιούχο στροντίου (SRI₂): Το ιωδιούχο στροντίου είναι επίσης εξαιρετικά διαλυτό στο νερό.
Η λύση
1. Προσθέστε μια πηγή ιόντων ιωδιδίου (i⁻): Αυτό θα μπορούσε να έχει τη μορφή ιωδιούχου καλίου (KI) ή ιωδιούχο νάτριο (NAI).
2. Αντίδραση: Όταν προστίθενται ιόντα ιωδιδίου στο διάλυμα, θα αντιδράσουν με τα ιόντα χαλκού (II) για να σχηματίσουν ιωδιούχο χαλκό (i) (Cui), το οποίο είναι ένα λευκό ίζημα:
`` `
2 cu²⁺ (aq) + 4 i⁻ (aq) → 2 cui (s) + i₂ (aq)
`` `
Επεξήγηση:
* Επιλεκτική βροχόπτωση: Με την προσθήκη ιόντων ιωδιδίου, στοχεύουμε ειδικά στα ιόντα χαλκού επειδή το ιωδιούχο χαλκό (Ι) είναι πολύ αδιάλυτο. Τα ιωδίδια μαγνησίου και στροντίου παραμένουν διαλυμένα, καθώς είναι εξαιρετικά διαλυτά.
* Οξείδωση-μείωση: Η αντίδραση περιλαμβάνει επίσης μια ταυτόχρονη διαδικασία μείωσης οξείδωσης όπου τα ιόντα ιωδιδίου οξειδώνονται σε ιώδιο (I₂).
Σημαντική σημείωση:
* Είναι σημαντικό να χρησιμοποιηθεί η σωστή στοιχειομετρική ποσότητα ιόντων ιωδιδίου για να εξασφαλιστεί ότι όλα τα ιόντα χαλκού κατακρημνίζονται. Τα περίσσεια ιόντων ιωδιδίων μπορούν να οδηγήσουν στο σχηματισμό διαλυτών συμπλοκών χαλκού, αποτρέποντας την πλήρη βροχόπτωση.
τελικό αποτέλεσμα:
Μετά την προσθήκη ιόντων ιωδιδίου, θα έχετε ένα λευκό ίζημα χαλκού (Ι) ιωδίδιο (CUI) στο κάτω μέρος του διαλύματος. Τα ιόντα μαγνησίου και στροντίου θα παραμείνουν σε λύση. Στη συνέχεια, μπορείτε να διαχωρίσετε το ίζημα μέσω διήθησης ή αποσύνθεσης.