Γιατί το νερό διαλύει πολλούς ιοντικούς δεσμούς;
1. Πολικότητα: Τα μόρια του νερού είναι πολικά, που σημαίνει ότι έχουν θετικό τέλος (άτομα υδρογόνου) και αρνητικό άκρο (άτομο οξυγόνου). Αυτή η πολικότητα δημιουργεί μια ισχυρή έλξη για τα ιόντα.
2. Δεσμός υδρογόνου: Το άτομο οξυγόνου στο νερό μπορεί να σχηματίσει δεσμούς υδρογόνου με τα θετικά άκρα άλλων μορίων, συμπεριλαμβανομένων των ιόντων. Αυτή η ισχυρή αλληλεπίδραση τραβάει τα ιόντα και αποδυναμώνει τον ιοντικό δεσμό.
3. Υψηλή διηλεκτρική σταθερά: Το νερό έχει υψηλή διηλεκτρική σταθερά, πράγμα που σημαίνει ότι μπορεί να μειώσει αποτελεσματικά την αντοχή των ηλεκτροστατικών αξιών μεταξύ των ιόντων. Αυτό αποδυναμώνει τον ιοντικό δεσμό και επιτρέπει στα ιόντα να χωριστούν.
Εδώ λειτουργεί λεπτομερώς:
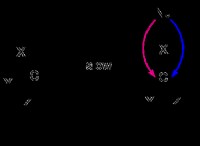
* έλξη στα ιόντα: Όταν μια ιοντική ένωση τοποθετείται σε νερό, τα θετικά άκρα των μορίων του νερού προσελκύονται από τα αρνητικά ιόντα και τα αρνητικά άκρα των μορίων νερού προσελκύονται από τα θετικά ιόντα.
* Ενυδάτωση: Αυτά τα αξιοθέατα προκαλούν τα μόρια του νερού να περιβάλλουν τα ιόντα, σχηματίζοντας ένα κέλυφος ενυδάτωσης. Αυτή η διαδικασία είναι γνωστή ως ενυδάτωση.
* αποδυνάμωση ιοντικών δεσμών: Η έλξη μεταξύ των μορίων νερού και των ιόντων είναι ισχυρότερη από την ηλεκτροστατική έλξη μεταξύ των ιόντων στην ιοντική ένωση. Αυτό προκαλεί την αποδυνάμωση του ιοντικού δεσμού και τελικά του σπασμένου.
* Διάλυση: Καθώς οι ιοντικοί δεσμοί σπάνε, τα ιόντα περιβάλλονται από μόρια νερού και διασκορπίζονται σε όλο το διάλυμα. Στη συνέχεια, η ένωση λέγεται ότι διαλύεται.
Στην ουσία, η πολικότητα του νερού, η συγκόλληση υδρογόνου και η υψηλή διηλεκτρική σταθερά επιτρέπουν να περιβάλλει αποτελεσματικά και να διαχωρίσει τα ιόντα, να σπάσει αποτελεσματικά τους ιοντικούς δεσμούς και να διαλύσει την ένωση.