Ποιος τύπος ατόμων θα σχηματίσει τυπικά έναν ιοντικό δεσμό;
Εδώ είναι μια κατανομή:
* Ηλεκτροργατιστικότητα: Αυτό είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια σε χημικό δεσμό.
* Μεγάλη διαφορά στην ηλεκτροαρνητικότητα: Όταν ένα άτομο έχει μια σημαντικά υψηλότερη ηλεκτροαρνητικότητα από το άλλο, θα προσελκύσει έντονα τα κοινόχρηστα ηλεκτρόνια, ουσιαστικά τους κλέβει από το άλλο άτομο. Αυτό έχει ως αποτέλεσμα το σχηματισμό ιόντων - ένα άτομο γίνεται θετικά φορτισμένο (κατιόν) και το άλλο γίνεται αρνητικά φορτισμένο (ανιόν).
Εδώ είναι οι τυπικοί τύποι ατόμων που μορφοποιούν ιοντικούς δεσμούς:
* μέταλλα: Τα μέταλλα τείνουν να έχουν χαμηλή ηλεκτροαρνητικότητα, καθιστώντας τα πιθανό να χάσουν ηλεκτρόνια και να σχηματίζουν κατιόντα.
* Μη μετάλλια: Τα μη μέταλλα τείνουν να έχουν υψηλή ηλεκτροαρνητικότητα, καθιστώντας τους πιθανό να κερδίσουν ηλεκτρόνια και να σχηματίζουν ανιόντα.
Παραδείγματα:
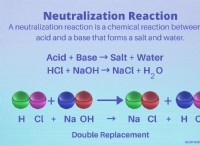
* νάτριο (Na) και χλώριο (CL): Το νάτριο είναι ένα μέταλλο με χαμηλή ηλεκτροαρνητικότητα, ενώ το χλώριο είναι μη μέταλλο με υψηλή ηλεκτροαρνητικότητα. Το νάτριο χάνει ένα ηλεκτρόνιο για να γίνει Na+, και το χλώριο κερδίζει ένα ηλεκτρόνιο για να γίνει cl-. Αυτά τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον, σχηματίζοντας έναν ιοντικό δεσμό.
* ασβέστιο (CA) και οξυγόνο (o): Το ασβέστιο είναι μέταλλο και το οξυγόνο είναι μη μέταλλο. Το ασβέστιο χάνει δύο ηλεκτρόνια για να γίνει Ca2+, και το οξυγόνο κερδίζει δύο ηλεκτρόνια για να γίνει O2-. Τα προκύπτοντα ιόντα σχηματίζουν ένα ιοντικό δεσμό.
Γενικά:
* μέταλλα + μη μέταλλα → ιοντικοί δεσμοί
* μη μέταλλα + μη μέταλλα → ομοιοπολικοί δεσμοί
Επιτρέψτε μου να ξέρω αν θέλετε περισσότερα παραδείγματα!