Πώς κάποιο άτομο σε ομοιοπολικούς δεσμούς γίνεται ελαφρώς αρνητικό ή θετικό τι είδους μορφή;
πολικοί ομοιοπολικοί δεσμοί:άνιση κοινή χρήση και μερική χρέωση
Οι ομοιοπολικοί δεσμοί σχηματίζονται όταν τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων. Ενώ πολλοί ομοιοπολικοί δεσμοί περιλαμβάνουν ίση κοινή χρήση ηλεκτρονίων, ορισμένοι δεσμοί έχουν άνιση κοινή χρήση Λόγω της διαφοράς στην ηλεκτροαρνητικότητα μεταξύ των εμπλεκόμενων ατόμων.
ηλεκτροργαρακτική είναι το μέτρο της ικανότητας ενός ατόμου να προσελκύει ηλεκτρόνια σε χημικό δεσμό. Τα άτομα με υψηλότερη ηλεκτροαρνητικότητα έχουν ισχυρότερη έλξη στα κοινόχρηστα ηλεκτρόνια.
Εδώ λειτουργεί:
1. Διαφορά στην ηλεκτροαρνητικότητα: Όταν δύο άτομα με διαφορετική ηλεκτροαρνητικότητα σχηματίζουν έναν ομοιοπολικό δεσμό, το άτομο με την υψηλότερη ηλεκτροαρνητικότητα θα προσελκύσει πιο έντονα τα κοινόχρηστα ηλεκτρόνια.
2. Παραμόρφωση σύννεφων ηλεκτρονίων: Αυτή η ισχυρότερη έλξη τραβάει το σύννεφο ηλεκτρονίων πιο κοντά στο πιο ηλεκτροαρνητικό άτομο, δημιουργώντας ένα ελαφρώς αρνητικό φορτίο (δ-) σε αυτό το άτομο. Το άλλο άτομο βιώνει ένα ελαφρύ θετικό φορτίο (δ+) λόγω του τραβηγμένου σύννεφου ηλεκτρονίων.
3. πολικός ομοιοπολικός δεσμός: Αυτή η ανομοιόμορφη κατανομή των ηλεκτρονίων έχει ως αποτέλεσμα ένα πολικό ομοιοπολικό δεσμό . Το μόριο έχει ένα ελαφρύ διαχωρισμό φορτίου, δημιουργώντας μια ροπή διπόλης .
Τύποι ομολόγων που σχηματίστηκαν:
* πολικοί ομοιοπολικοί δεσμοί: Αυτοί οι δεσμοί σχηματίζονται όταν υπάρχει σημαντική διαφορά στην ηλεκτροαρνητικότητα μεταξύ των δύο ατόμων. Είναι υπεύθυνοι για τις ιδιότητες πολλών σημαντικών μορίων, όπως το νερό.
* Μη πολικοί ομοιοπολικοί δεσμοί: Όταν τα άτομα με παρόμοια ηλεκτροαρνητικότητα μοιράζονται ηλεκτρόνια, ο δεσμός είναι μη πολικός. Το σύννεφο ηλεκτρονίων μοιράζεται εξίσου και δεν υπάρχει διαχωρισμός φορτίου.
Παραδείγματα:
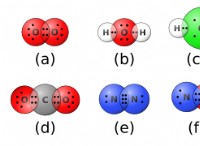
* νερό (h₂o): Το οξυγόνο έχει υψηλότερη ηλεκτροαρνητικότητα από το υδρογόνο, οδηγώντας σε πολικό ομοιοπολικό δεσμό. Το άτομο οξυγόνου γίνεται ελαφρώς αρνητικό (δ-) και τα άτομα υδρογόνου γίνονται ελαφρώς θετικά (δ+).
* μεθάνιο (ch₄): Ο άνθρακας και το υδρογόνο έχουν παρόμοια ηλεκτροαρνητικότητα, με αποτέλεσμα μη πολικούς ομοιοπολικούς δεσμούς.
Συνοπτικά:
* πολικοί ομοιοπολικοί δεσμοί μορφή όταν άτομα με διαφορετικά ηλεκτροαρνητικότητα μοιράζονται ηλεκτρόνια άνισα.
* Αυτή η άνιση κοινή χρήση δημιουργεί Μερικές χρεώσεις (Δ+ και Δ-) στα εμπλεκόμενα άτομα.
* Η διαφορά στην ηλεκτροαρνητικότητα καθορίζει την πολικότητα του δεσμού, επηρεάζοντας τις συνολικές ιδιότητες του μορίου.