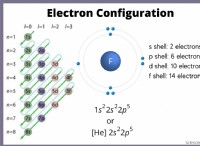
Πώς είναι ο περιοδικός πίνακας;
σειρές (περιόδους):
* Κάθε σειρά αντιπροσωπεύει μια περίοδο και αντιστοιχεί στον αριθμό των κελυφών ηλεκτρονίων (επίπεδα ενέργειας) ένα άτομο έχει.
* Τα στοιχεία την ίδια περίοδο έχουν τον ίδιο αριθμό κελύφη ηλεκτρονίων.
* Η μετάβαση από αριστερά προς τα δεξιά κατά τη διάρκεια μιας περιόδου, ο ατομικός αριθμός αυξάνεται και ο αριθμός των ηλεκτρονίων στο εξωτερικό κέλυφος (ηλεκτρόνια σθένους) αυξάνεται.
στήλες (ομάδες):
* Κάθε στήλη αντιπροσωπεύει μια ομάδα και αντιστοιχεί στον αριθμό των ηλεκτρονίων σθένους που έχει ένα άτομο.
* Τα στοιχεία της ίδιας ομάδας έχουν παρόμοιες χημικές ιδιότητες επειδή έχουν τον ίδιο αριθμό ηλεκτρονίων σθένους.
* Η ομάδα 1 (αλκαλικά μέταλλα) έχει όλα ένα ηλεκτρόνιο σθένους, η ομάδα 2 (μέταλλα αλκαλικής γης) έχουν δύο και ούτω καθεξής.
* Οι ομάδες 3-12 ονομάζονται μεταβατικά μέταλλα και έχουν ποικίλους αριθμούς ηλεκτρονίων σθένους.
* Ομάδες 13-18 ονομάζονται κύρια στοιχεία ομάδας.
μέταλλα, μη μέταλλα και μεταλλοειδή:
* Ο περιοδικός πίνακας οργανώνεται επίσης από τους τύπους των στοιχείων:
* μέταλλα βρίσκονται γενικά στην αριστερή πλευρά του τραπεζιού και είναι καλοί αγωγοί θερμότητας και ηλεκτρικής ενέργειας.
* Μη μέταλλα βρίσκονται γενικά στη δεξιά πλευρά του τραπεζιού και είναι κακοί αγωγοί θερμότητας και ηλεκτρικής ενέργειας.
* Metalloids βρίσκονται κατά μήκος της "σκάλας" που διαχωρίζουν τα μέταλλα και τα μη μέταλλα και έχουν ιδιότητες τόσο των μετάλλων όσο και των μη μεταλλικών.
Άλλα σημαντικά χαρακτηριστικά:
* Λανθανίδια και ακτινίδια: Αυτά τα στοιχεία, γνωστά και ως στοιχεία σπάνιων γαιών, τοποθετούνται συνήθως κάτω από το κύριο σώμα του περιοδικού πίνακα. Ανήκουν στις περιόδους 6 και 7, αντίστοιχα.
* Ατομική μάζα: Οι ατομικές μάζες στοιχείων παρατίθενται κάτω από τα σύμβολα τους. Αυτές οι τιμές γενικά αυξάνονται καθώς μετακινείτε και κάτω από τον περιοδικό πίνακα.
Η οργάνωση του περιοδικού πίνακα καθιστά ένα ισχυρό εργαλείο για την κατανόηση της συμπεριφοράς των στοιχείων και την πρόβλεψη των ιδιοτήτων τους. Μας επιτρέπει να βλέπουμε μοτίβα και σχέσεις μεταξύ των στοιχείων, τα οποία είναι ζωτικής σημασίας για τη μελέτη της χημείας και την κατανόηση του κόσμου γύρω μας.