Ενώσεις που σχηματίζονται από στοιχεία της ομάδας 14
Στον περιοδικό πίνακα, ο άνθρακας (C), το πυρίτιο (Si), το γερμάνιο (Ge), ο κασσίτερος (Sn) και ο μόλυβδος (Pb) είναι γνωστοί ως ομάδα 14 ή μέλη της οικογένειας άνθρακα στο το p-block , του οποίου η εξωτερική διαμόρφωση ηλεκτρονίων ns2np2 βρίσκεται με μόνο δύο ηλεκτρόνια στο τροχιακό p.
Αν προσέξουμε την ακτίνα των στοιχείων της ομάδας 14, θα διαπιστώσουμε ότι η ακτίνα των στοιχείων της ομάδας 14 είναι μικρότερη από την ακτίνα των στοιχείων της ομάδας 13, κυρίως λόγω του ενεργού πυρηνικού φορτίου. Η ακτίνα αυξάνεται από άνθρακα σε πυρίτιο, αλλά στη συνέχεια μειώνεται, κυρίως λόγω των τροχιακών d και f.
Αν συγκρίνετε την ενέργεια ιονισμού αυτής της ομάδας με αυτήν της ομάδας 13, τότε θα διαπιστώσετε ότι η ενέργεια ιονισμού της είναι πολύ υψηλή, κυρίως λόγω του μεγέθους του ατόμου της. Επίσης, έχει βρεθεί ότι αν πάμε από πάνω προς τα κάτω, τότε υπάρχει μείωση της ενθαλπίας ιονισμού.
Τα στοιχεία της ομάδας 14 έχουν πολύ υψηλά σημεία τήξης και σημεία βρασμού, κυρίως λόγω της στερεάς δομής τους. Λόγω της παρουσίας δύο δεσμών σε Sn και Pb, έχουν χαμηλά σημεία τήξης. Ο άνθρακας έχει δομή πλέγματος και το σημείο τήξεώς του είναι πολύ υψηλότερο από όλα τα άλλα. Καθώς προχωράμε πιο κάτω σε αυτήν την ομάδα, υπάρχει μείωση στο σημείο τήξης.
Ενώσεις άνθρακα
Ο αριθμός των ενώσεων που σχετίζονται με τον άνθρακα είναι πολύ μεγαλύτερος από αυτόν των ενώσεων που αποτελούνται από όλα τα άλλα στοιχεία. Ο άνθρακας σχηματίζει πολλές ενώσεις λόγω των διαφόρων ιδιοτήτων του, στις οποίες το μεθάνιο (CH4) είναι γνωστό ως η μητρική του ένωση. Εκτός από αυτό, οι υδρογονάνθρακες είναι επίσης γνωστοί ως η μητρική τους ένωση, η οποία σχηματίζεται από το συνδυασμό υδρογόνου και άνθρακα. Στο σχηματισμό αυτών των ενώσεων υπάρχουν επίσης πολλοί δεσμοί, στους οποίους φαίνονται απλοί, διπλοί ή τριπλοί δεσμοί.
Με βάση τον αριθμό των δεσμών, οι ενώσεις άνθρακα κατατάσσονται σε δύο μεγάλες κατηγορίες. Αυτό μπορεί να φανεί κυρίως μεταξύ ατόμων C, τα οποία βρίσκονται κυρίως μεταξύ ενώσεων κορεσμένου άνθρακα και ακόρεστων ενώσεων άνθρακα, οι οποίες εξηγούνται παρακάτω:
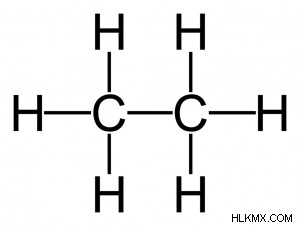
Ενώσεις κορεσμένου άνθρακα- Οι ενώσεις κορεσμένου άνθρακα είναι ενώσεις άνθρακα στις οποίες τα διαφορετικά άτομα άνθρακα σε μια αλυσίδα ή δακτύλιο συνδέονται αποκλειστικά με απλούς δεσμούς. Τα αλκάνια είναι ενώσεις άνθρακα με κορεσμένη αλυσίδα και δομή παρόμοια με αυτή του αιθανίου, όπως φαίνεται παρακάτω.
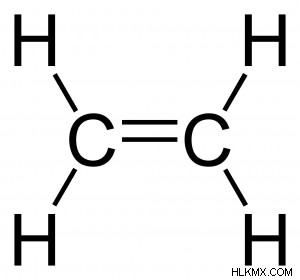
Ακόρεστες ενώσεις άνθρακα- Οι ακόρεστες ενώσεις άνθρακα περιέχουν διπλούς ή τριπλούς δεσμούς με τα άτομα άνθρακα, με αυτούς τους δεσμούς να τους συνδέουν σε μια αλυσίδα ή δακτύλιο. Οι πιο διαδεδομένες ενώσεις ακόρεστης αλυσίδας άνθρακα είναι τα αλκάνια και τα αλκίνια. Τα αλκάνια συνδέονται κυρίως με διπλούς δεσμούς μεταξύ των ατόμων άνθρακα, ενώ τα αλκίνια συνδέονται με τριπλούς δεσμούς μεταξύ των ατόμων άνθρακα. Το παρακάτω είναι ένα παράδειγμα αιθενίου.
Πυρίτιο
Ενώσεις όπως το πυρίτιο και τα πυριτικά άλατα βρίσκονται στο 95% περίπου του φλοιού της Γης. Το πυρίτιο είναι κυρίως γνωστό ως διοξείδιο του πυριτίου. Μερικές άλλες μορφές πυριτίου είναι ο χαλαζίας, ο κριστοβαλίτης, ο τριδυμίτης κ.λπ. Το πυρίτιο είναι μια ομοιοπολική ένωση και είναι τετραεδρική με τέσσερα άτομα οξυγόνου.
Σιλικόνες- Οι σιλικόνες είναι συστατικό πολυμερών οργανοπυριτίου, τα οποία περιλαμβάνουν επαναλαμβανόμενες μονάδες. Κατασκευάζεται αντικαθιστώντας μια ομάδα αλκυλίου ή αρυλίου. Αξίζει επίσης να σημειωθεί ότι περιβάλλεται από μια μη πολική αλκυλομάδα.
Πυριτικά- Ο ζεόλιθος είναι ένας άλλος τύπος πυριτικού άλατος, με τη δομή SiO4 (τέσσερα άτομα οξυγόνου συνδεδεμένα με ένα μόνο άτομο πυριτίου). Οι πυριτικοί δακτύλιοι μπορούν να σχηματίσουν και αλυσίδες και τρισδιάστατες δομές.
Ζεόλιθοι- Οι ζεόλιθοι κάποτε ήταν γνωστό ότι χρησιμοποιούνταν ως καταλύτες στην πετροχημική βιομηχανία. Αυτά συνδυάζονται με αλκοόλ και στη συνέχεια μετατρέπονται σε βενζίνη χρησιμοποιώντας έναν ζεόλιθο που ονομάζεται ZSM-5. Οι ζεόλιθοι χρησιμοποιούνται πιο συχνά για να μαλακώσουν το σκληρό νερό.
Γερμάνιο
Τα αλογόνα περιγράφονται ως αλογονίδια, το οξυγόνο ως οξείδια και το υδρογόνο ως υδρίδια σε αυτήν την ενότητα. Ακολουθούν ορισμένες δυαδικές ενώσεις, πρόσθετες ενώσεις γερμανίου και τιμές οξείδωσης γερμανίου για όλες τις ενώσεις, ιδιαίτερα σε στοιχεία p-block. Με βάση τον αριθμό οξείδωσης, παρέχεται επίσης μια ηλεκτρική διαμόρφωση. Οι αριθμοί οξείδωσης 4, 2 και -4 είναι οι πιο συχνοί για το γερμάνιο.
Υδρίδια | Τετραϋδρίδιο γερμανίου:GeH4 Εξαϋδρίδιο του διγερμανίου:Ge2H6 |
Φθορίδια | Διφθοριούχο γερμάνιο:GeF2 Τετραφθοριούχο γερμάνιο:GeF4 |
Χλωρίδια | Διχλωριούχο γερμάνιο:GeCl2 Τετραχλωριούχο γερμάνιο:GeCl4 |
Ιωδίδια | Διωδιούχο γερμάνιο:GeI2 Τετραϊωδιούχο γερμάνιο:GeI4 |
Οξείδια | Οξείδιο του γερμανίου:GeO Διοξείδιο του γερμανίου:GeO2 |
Κασσίτερος
Ο κασσίτερος βρίσκεται στην ορυκτή μορφή του οξειδίου του κασσιτέρου (IV) στο SnO2, γνωστό και ως οξείδιο του κασσιτέρου, το οποίο υπάρχει στον κασσίτερο στην κατάσταση οξείδωσης 4. Το οξείδιο του κασσιτέρου (II) και το οξείδιο του κασσιτέρου είναι δύο μορφές SnO. Υπάρχει σε δύο καταστάσεις οξείδωσης. Ο βρωμιούχος κασσίτερος (II), γνωστός και ως SnBr2, χλωριούχος κασσίτερος (II), SnCl2, φθοριούχος κασσίτερος (II), ιωδιούχος κασσίτερος (II), SnF2 και ιωδιούχος κασσίτερος (II), είναι μια ένωση που περιέχει κασσίτερο στην κατάσταση οξείδωσης 2. Ο βρωμιούχος κασσίτερος (IV) αποτελείται από SnBr4, ο χλωριούχος κασσίτερος (IV) αποτελείται από SnCl4, ο φθοριούχος κασσίτερος (IV) αποτελείται από SnF4 και ο ιωδιούχος κασσίτερος (IV) αποτελείται από SnI4.
Συμπέρασμα
Τα κύρια στοιχεία της ομάδας 14 είναι ο άνθρακας (C), το πυρίτιο (Si), το γερμάνιο (Ge), ο κασσίτερος (Sn) και ο μόλυβδος (Pb), τα οποία είναι χρήσιμα όχι μόνο ως στοιχεία αλλά και ως ενώσεις. Απασχολούνται σε διάφορους τομείς, από ιατρικούς έως βιομηχανικούς. Στη φύση, αρκετά από αυτά τα συστατικά μπορούν να βρεθούν σε αφθονία. Ο άνθρακας, το πυρίτιο και το γερμάνιο, από την άλλη πλευρά, έχουν εξαιρετικά υψηλές θερμοκρασίες τήξης και βρασμού λόγω των απίστευτα σταθερών στερεών δομών τους.




