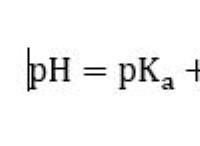Ποιοι υγροί διαλύτες είναι καλύτεροι για τη διάλυση ιοντικών ενώσεων και γιατί;
* πολικότητα: Οι ιοντικές ενώσεις συγκρατούνται από ισχυρές ηλεκτροστατικές δυνάμεις μεταξύ θετικών και αρνητικών φορτισμένων ιόντων. Οι πολικοί διαλύτες όπως το νερό έχουν θετικό και αρνητικό άκρο λόγω της ανομοιόμορφης κατανομής των ηλεκτρονίων (το οξυγόνο είναι πιο ηλεκτροαρνητικό από το υδρογόνο). Αυτή η πολικότητα επιτρέπει στα μόρια του διαλύτη να αλληλεπιδρούν με τα ιόντα στην ιοντική ένωση, "τραβώντας αποτελεσματικά τους.
* δεσμός υδρογόνου: Το νερό σχηματίζει επίσης ισχυρούς δεσμούς υδρογόνου με τα ιόντα, βοηθώντας περαιτέρω στη διαδικασία διαλυτοποίησης.
* Διευθυντική σταθερά: Το νερό έχει υψηλή διηλεκτρική σταθερά, πράγμα που σημαίνει ότι αποδυναμώνει την ηλεκτροστατική έλξη μεταξύ των ιόντων, καθιστώντας ευκολότερη τη διαχωρισμό και τη διάλυση.
Άλλοι πολικοί διαλύτες που μπορούν να διαλύουν τις ιοντικές ενώσεις περιλαμβάνουν:
* αιθανόλη (c₂h₅oh): Είναι λιγότερο πολικό από το νερό, αλλά μπορεί ακόμα να διαλύσει κάποιες ιοντικές ενώσεις.
* μεθανόλη (ch₃oh): Παρόμοια με την αιθανόλη, μπορεί να διαλύσει μερικές ιοντικές ενώσεις λόγω της πολικότητάς της.
* ακετόνη (ch₃coch₃): Ένας πολικός διαλύτης, αλλά λιγότερο αποτελεσματικός από το νερό.
Γιατί οι μη πολικοί διαλύτες δεν είναι καλοί για τη διάλυση ιοντικών ενώσεων:
* Έλλειψη πολικότητας: Οι μη πολικοί διαλύτες όπως το εξάνιο ή το πετρέλαιο δεν έχουν τα θετικά και αρνητικά άκρα που είναι απαραίτητα για να αλληλεπιδρούν με τα φορτισμένα ιόντα σε μια ιοντική ένωση. Δεν μπορούν να ξεπεράσουν αποτελεσματικά τις ισχυρές ηλεκτροστατικές δυνάμεις που κρατούν τα ιόντα μαζί.
Συνοπτικά, οι καλύτεροι διαλύτες για τη διάλυση των ιοντικών ενώσεων είναι πολικοί διαλύτες όπως το νερό λόγω της ικανότητάς τους να αλληλεπιδρούν με τα φορτισμένα ιόντα, να αποδυναμώσουν την ηλεκτροστατική έλξη και να διευκολύνουν τον διαχωρισμό τους.