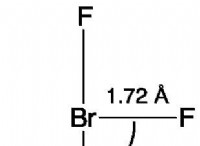
Τα άτομα των οποίων τα εξωτερικά κελύφη Elecron περιέχουν οκτώ ηλεκτρόνια τείνουν να σχηματίζουν ιοντικούς δεσμούς σε υδατικά διαλύματα;
* σταθερότητα: Τα άτομα με πλήρες εξωτερικό κέλυφος οκτώ ηλεκτρονίων (ή δύο για υδρογόνο και ήλιο) θεωρούνται σταθερά και μη αντιδραστικά. Αυτό οφείλεται στο γεγονός ότι έχουν κατάσταση χαμηλής ενέργειας και δεν επιθυμούν να κερδίσουν ή να χάσουν ηλεκτρόνια.
* σχηματισμός ιονικού δεσμού: Οι ιοντικοί δεσμοί εμφανίζονται όταν ένα άτομο δωρίζει ένα ηλεκτρόνιο σε άλλο άτομο, σχηματίζοντας ένα θετικά φορτισμένο ιόν (κατιόν) και ένα αρνητικά φορτισμένο ιόν (ανιόν). Αυτό συμβαίνει συνήθως όταν ένα άτομο έχει έντονη τάση να κερδίζει ηλεκτρόνια (υψηλή ηλεκτροαρνητικότητα) και το άλλο έχει έντονη τάση να χάσει ηλεκτρόνια (χαμηλή ηλεκτροαρνητικότητα).
* Κανόνας οκτάδων: Τα άτομα με πλήρη οκτάδα δεν χρειάζεται να κερδίσουν ή να χάσουν ηλεκτρόνια για να επιτύχουν σταθερότητα. Είναι ήδη ικανοποιημένοι και λιγότερο πιθανό να συμμετάσχουν σε σχηματισμό ιονικών ομολόγων.
Παράδειγμα:
* Τα ευγενή αέρια (He, Ne, Ar, Kr, Xe, RN) έχουν ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων και είναι εξαιρετικά μη αντιδραστικά. Σπάνια σχηματίζουν ιόντα ή συμμετέχουν σε χημικές αντιδράσεις.
Εξαιρέσεις:
Ενώ τα άτομα με πλήρη οκτάδα γενικά δεν σχηματίζουν ιοντικούς δεσμούς, υπάρχουν μερικές εξαιρέσεις:
* Μεγάλα, εξαιρετικά φορτισμένα ιόντα: Ορισμένα μεγάλα ιόντα με υψηλό θετικό φορτίο μπορούν ακόμα να σχηματίσουν ιοντικούς δεσμούς ακόμη και αν έχουν πλήρη οκτάδα. Αυτά τα ιόντα μπορεί να έχουν μια μικρή τάση να προσελκύουν ηλεκτρόνια για να εξισορροπήσουν την χρέωση τους.
* Συγκροτήματα συντονισμού: Τα μεταβατικά μέταλλα με πλήρη οκτάδα μπορούν ακόμα να σχηματίζουν συντεταγμένες ομοιοπολικούς δεσμούς σε υδατικό διάλυμα, όπου μοιράζονται ηλεκτρόνια με προσδέματα (μόρια ή ιόντα).
Συνοπτικά:
Τα άτομα με πλήρη οκτάδα είναι συνήθως μη αντιδραστικά και δεν τείνουν να σχηματίζουν ιοντικούς δεσμούς σε υδατικά διαλύματα. Ωστόσο, υπάρχουν κάποιες εξαιρέσεις ανάλογα με παράγοντες όπως το μέγεθος και το χρέος των ιόντων.