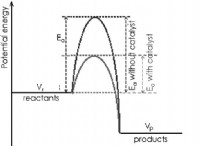
Τι σημαίνει η διατήρηση όταν σχετίζεται με χημικές αντιδράσεις;
Διατήρηση της μάζας:
* Τα άτομα δεν δημιουργούνται ή καταστρέφονται κατά τη διάρκεια χημικής αντίδρασης. Απλώς αναδιαμορφώνονται σε διαφορετικά μόρια.
* Η συνολική μάζα των αντιδραστηρίων (υλικά εκκίνησης) πρέπει να ισούται με τη συνολική μάζα των προϊόντων (ουσίες που σχηματίζονται). Αυτό είναι γνωστό ως ο νόμος της διατήρησης της μάζας
* Παράδειγμα: Στην αντίδραση του αερίου υδρογόνου (Η2) με αέριο οξυγόνου (Ο2) για να σχηματίσει νερό (Η2Ο), η συνολική μάζα του υδρογόνου και του οξυγόνου πριν από την αντίδραση πρέπει να ισούται με τη συνολική μάζα του παραγόμενου νερού.
Διατήρηση της ενέργειας:
* Η ενέργεια δεν μπορεί να δημιουργηθεί ή να καταστραφεί, μετατρέπεται μόνο από τη μία μορφή σε άλλη.
* Σε μια χημική αντίδραση, η ενέργεια είτε απελευθερώνεται (εξωθερμική αντίδραση) είτε απορροφάται (ενδοθερμική αντίδραση).
* Η συνολική ενέργεια των αντιδραστηρίων και των προϊόντων παραμένει σταθερή, παρόλο που μπορεί να διανεμηθεί διαφορετικά.
* Παράδειγμα: Η καύση του ξύλου απελευθερώνει τη θερμική ενέργεια, αλλά η συνολική ενέργεια του ξύλου και του οξυγόνου πριν από την καύση είναι η ίδια με τη συνολική ενέργεια των στάχνων, των αερίων και της θερμότητας που απελευθερώνεται μετά την καύση.
Διατήρηση της χρέωσης:
* Το συνολικό φορτίο των αντιδραστηρίων πρέπει να ισούται με το συνολικό φορτίο των προϊόντων.
* Αυτό οφείλεται στο γεγονός ότι ο αριθμός των ηλεκτρονίων και των πρωτονίων στο σύστημα αντίδρασης παραμένει σταθερός.
* Παράδειγμα: Στην αντίδραση του μετάλλου νατρίου (Na) με αέριο χλωρίου (CL2) για να σχηματίσει χλωριούχο νάτριο (NaCl), το συνολικό φορτίο των αντιδραστηρίων (0) πρέπει να ισούται με το συνολικό φορτίο των προϊόντων (0).
Βασικά σημεία που πρέπει να θυμάστε για τη διατήρηση σε χημικές αντιδράσεις:
* Μας βοηθά να κατανοήσουμε τις θεμελιώδεις αρχές που διέπουν τη χημική αλλαγή.
* Μας επιτρέπει να εξισορροπήσουμε τις χημικές εξισώσεις, διασφαλίζοντας ότι ο ίδιος αριθμός ατόμων κάθε στοιχείου υπάρχουν και στις δύο πλευρές της εξίσωσης.
* Τονίζει τη σημασία της λογιστικής για όλα τα αντιδραστήρια και τα προϊόντα σε μια αντίδραση για την κατανόηση των ενεργειακών αλλαγών και της ισορροπίας μάζας που εμπλέκονται.
Με την κατανόηση της αρχής της διατήρησης σε χημικές αντιδράσεις, μπορούμε να προβλέψουμε και να αναλύσουμε τα αποτελέσματα των χημικών αντιδράσεων και να αναπτύξουμε νέες χημικές διεργασίες.