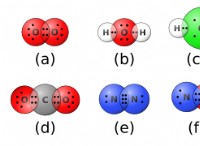
Θα μπορούσαν οι K και CL να σχηματίσουν έναν πολικό ομοιοπολικό δεσμό;
* Διαφορά ηλεκτροαρνητικότητας: Το κάλιο (Κ) έχει ηλεκτροαρνητικότητα 0,82, ενώ το χλώριο (CL) έχει ηλεκτροαρνητικότητα 3,16. Η διαφορά μεταξύ αυτών των τιμών είναι αρκετά μεγάλη (2,34).
* σχηματισμός ιονικού δεσμού: Μια μεγάλη διαφορά ηλεκτροαρνητικότητας δείχνει ότι το χλώριο έχει πολύ ισχυρότερη έλξη σε κοινά ηλεκτρόνια από το κάλιο. Αυτό οδηγεί σε χλώριο ουσιαστικά "κλέβει" το ηλεκτρόνιο από το κάλιο, σχηματίζοντας ένα αρνητικά φορτισμένο χλωριούχο ιόν (CL-) και ένα θετικά φορτισμένο ιόν καλίου (Κ+). Αυτά τα αντίθετα φορτισμένα ιόντα προσελκύουν ο ένας τον άλλον, σχηματίζοντας έναν ιοντικό δεσμό.
Βασικά σημεία:
* πολικοί ομοιοπολικοί δεσμοί Προκύπτουν όταν υπάρχει μέτρια διαφορά ηλεκτροαρνητικότητας μεταξύ δύο ατόμων, οδηγώντας σε άνιση κατανομή των ηλεκτρονίων.
* Ιονικά ομόλογα μορφή όταν υπάρχει μεγάλη διαφορά ηλεκτροαρνητικότητας, με αποτέλεσμα την πλήρη μεταφορά των ηλεκτρονίων και τον σχηματισμό ιόντων.