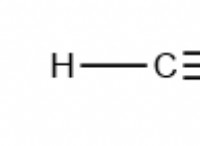
Ποιος τύπος μορίων θα είχε το χαμηλότερο σημείο τήξης;
Παράγοντες που επηρεάζουν το σημείο τήξης
* Διαμοριακές δυνάμεις: Όσο ισχυρότερες είναι οι διαμοριακές δυνάμεις μεταξύ των μορίων, τόσο υψηλότερο είναι το σημείο τήξης. Ακολουθεί μια ιεραρχία των διαμοριακών δυνάμεων από το πιο αδύναμο έως το ισχυρότερο:
* Δυνάμεις διασποράς του Λονδίνου (LDF): Παρουσιάζονται σε όλα τα μόρια, αυτές οι δυνάμεις προκύπτουν από προσωρινές διακυμάνσεις στην κατανομή ηλεκτρονίων. Είναι γενικά αδύναμοι αλλά αυξάνονται με μοριακό μέγεθος και επιφάνεια.
* αλληλεπιδράσεις διπόλης-διπόλης: Εμφανίζονται μεταξύ πολικών μορίων (μόρια με μόνιμα διπόλια). Αυτές οι δυνάμεις είναι ισχυρότερες από τις LDF.
* δεσμός υδρογόνου: Ένας ειδικός τύπος αλληλεπίδρασης διπολικής-δίπολης που περιλαμβάνει υδρογόνο συνδεδεμένο με ένα εξαιρετικά ηλεκτροαρνητικό άτομο (όπως το οξυγόνο, το άζωτο ή το φθοριοειδές). Αυτές είναι οι ισχυρότερες διαμοριακές δυνάμεις.
* Μοριακό μέγεθος και σχήμα: Τα μεγαλύτερα μόρια με περισσότερη επιφάνεια έχουν ισχυρότερα LDF, οδηγώντας σε υψηλότερα σημεία τήξης. Η διακλάδωση σε μόρια μπορεί να μειώσει την επιφάνεια, μειώνοντας το σημείο τήξης.
* Συμμετρία: Τα συμμετρικά μόρια συχνά συσκευάζονται πιο σφιχτά, οδηγώντας σε ισχυρότερες ενδομοριακές δυνάμεις και υψηλότερα σημεία τήξης.
Μόρια με χαμηλότερα σημεία τήξης
Με βάση αυτούς τους παράγοντες, τα μόρια με τα ακόλουθα χαρακτηριστικά θα έχουν γενικά τα χαμηλότερα σημεία τήξης:
* Μικρά, μη πολικά μόρια: Αυτά τα μόρια παρουσιάζουν μόνο αδύναμα LDFs. Παραδείγματα:
* Ευγενή αέρια (He, Ne, AR, κ.λπ.)
* Απλοί υδρογονάνθρακες (μεθάνιο, αιθάνιο, προπάνιο)
* Μόρια με περιορισμένες διαμοριακές αλληλεπιδράσεις: Ακόμη και αν τα μόρια είναι κάπως μεγαλύτερα, εάν δεν διαθέτουν ισχυρές αλληλεπιδράσεις διπολικών-δίπολων ή δεσμού υδρογόνου, τα σημεία τήξης τους θα είναι χαμηλότερα.
Παραδείγματα
* ήλιο (He): Αυτό το ευγενές αέριο έχει το χαμηλότερο σημείο τήξης οποιουδήποτε στοιχείου λόγω των εξαιρετικά αδύναμων LDF του.
* μεθάνιο (CH4): Ένα μικρό, μη πολικό μόριο με μόνο LDFs, έχει ένα χαμηλό σημείο τήξης.
* προπάνιο (C3H8): Ένας μεγαλύτερος υδρογονάνθρακας με μόνο LDFs, το σημείο τήξης του είναι ελαφρώς υψηλότερο από το μεθάνιο, αλλά εξακολουθεί να είναι σχετικά χαμηλό.
Σημαντική σημείωση: Υπάρχουν εξαιρέσεις από αυτές τις γενικεύσεις. Η μοριακή δομή, οι ειδικές αλληλεπιδράσεις και άλλοι παράγοντες μπορούν να επηρεάσουν τα σημεία τήξης.