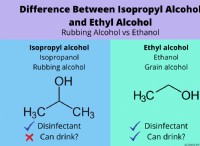
Ortho - υδροξυακετοφαινόνη εναντίον para polarity;
Κατανόηση της πολικότητας
* πολικότητα Στα μόρια προκύπτει από τις διαφορές στην ηλεκτροαρνητικότητα μεταξύ των ατόμων. Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια σε έναν δεσμό.
* οξυγόνο είναι πιο ηλεκτροαρνητικό από άνθρακα και υδρογόνο . Αυτό σημαίνει ότι το οξυγόνο τραβάει την πυκνότητα των ηλεκτρονίων προς τον εαυτό του σε δεσμούς, δημιουργώντας μερικές αρνητικές χρεώσεις (δ-) στα οξυγόνου και μερικές θετικές χρεώσεις (δ+) στα άτομα άνθρακα ή υδρογόνου.
Συγκρίνοντας τις δομές
* ορθο-υδροξυακετοφαινόνη: Η ομάδα υδροξυλίου (-ΟΗ) και η ομάδα καρβονυλίου (C =O) είναι δίπλα στο άλλο στο δακτύλιο βενζολίου.
* para-υδροξυακετοφαινόνη: Η ομάδα υδροξυλίου (-ΟΗ) και η ομάδα καρβονυλίου (C =O) τοποθετούνται απέναντι από το άλλο στο δακτύλιο βενζολίου.
Ανάλυση πολικότητας
1. Ενδομοριακή σύνδεση υδρογόνου: Στην ορθο-υδροξυακετοφαινόνη, η ομάδα υδροξυλίου μπορεί να σχηματίσει δεσμό υδρογόνου με το οξυγόνο του καρβονυλίου. Αυτός ο ενδομοριακός δεσμός υδρογόνου δημιουργεί μια πιο εντοπισμένη, ισχυρή διπολική στιγμή.
2. Διανομή ηλεκτρονίων: Ο δεσμός υδρογόνου στην ορθο-υδροξυακετοφαινόνη επηρεάζει την κατανομή των ηλεκτρονίων, την πυκνότητα ηλεκτρονίων συγκέντρωσης γύρω από την υδροξυλομάδα και την ομάδα καρβονυλίου, καθιστώντας το μόριο ακόμα πιο πολικό.
3. Ο προσανατολισμός του para επιτρέπει περισσότερη ελευθερία κίνησης των ομάδων καρβονυλίου και υδροξυλίου, μειώνοντας την πιθανότητα ισχυρής ενδομοριακής σύνδεσης υδρογόνου. Αυτό οδηγεί σε μια πιο διασκορπισμένη διπολική στιγμή σε σύγκριση με την ορθο-υδροξυακετοφαινόνη.
Συμπέρασμα
* ορθο-υδροξυακετοφαινόνη είναι Περισσότερη πολική από την παρα-υδροξυακετοφαινόνη λόγω της ισχυρότερης ενδομοριακής σύνδεσης υδρογόνου και της προκύπτουσας εντοπισμένης διπολικής ροπής.
Σημαντικές σημειώσεις:
* Διαλυτότητα: Η υψηλότερη πολικότητα της ορθο-υδροξυακετοφαινόνης συνήθως οδηγεί σε μεγαλύτερη διαλυτότητα σε πολικούς διαλύτες όπως το νερό.
* Αντιδραστικότητα: Η αυξημένη πολικότητα μπορεί επίσης να επηρεάσει την αντιδραστικότητα στις χημικές αντιδράσεις.
Επιτρέψτε μου να ξέρω αν έχετε περαιτέρω ερωτήσεις!