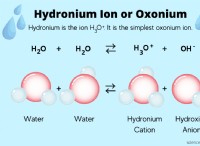
Τι είδους δεσμός παρατηρείται στο οξυγόνο;
Εδώ είναι γιατί:
* ομοιοπολικός δεσμός: Τα άτομα οξυγόνου μοιράζονται ηλεκτρόνια για να επιτευχθούν σταθερή διαμόρφωση οκτάδων (8 ηλεκτρόνια στο εξωτερικό τους κέλυφος).
* Διπλός δεσμός: Κάθε άτομο οξυγόνου συνεισφέρει δύο ηλεκτρόνια στον δεσμό, με αποτέλεσμα την κοινή χρήση τεσσάρων ηλεκτρονίων συνολικά.
Επιτρέψτε μου να ξέρω αν θέλετε να μάθετε περισσότερα για την ομοιοπολική σύνδεση!