Πώς να γράψετε μια καθαρή ιοντική εξίσωση;
Για να γράψετε μια καθαρή ιοντική εξίσωση, πρέπει πρώτα να αναλύσετε τους υδατικούς συμμετέχοντες στα συστατικά τους ιόντα και μετά να εξαλείψετε τα ιόντα που υπάρχουν και στις δύο πλευρές (ιόντα θεατή) της εξίσωσης.
Πριν από λίγο καιρό, συζητήσαμε πώς να γράψουμε μια ισορροπημένη χημική εξίσωση. Σήμερα, ας το κάνουμε ένα βήμα και ας μάθουμε πώς να γράφουμε μια καθαρή ιοντική εξίσωση.
Μια βασική χημική εξίσωση περιλαμβάνει τα αντιδρώντα και τα προϊόντα στην πλήρη μοριακή τους μορφή. Μια ιοντική εξίσωση, από την άλλη πλευρά, διασπά τα υδατικά συστατικά που εμπλέκονται στην αντίδραση στα συστατικά τους ιόντα. Μια καθαρή ιοντική εξίσωση το πηγαίνει αυτό ένα βήμα παραπέρα και περιλαμβάνει μόνο ιόντα και μόρια που συμμετέχουν άμεσα στην αντίδραση και καταργούν τα ιόντα των θεατών.

Μια ιοντική εξίσωση ενσωματώνει ιόντα υδατικών διαλυμάτων παρά τις πλήρεις μοριακές τους μορφές. (Φωτογραφία:Erika J Mitchell/Shutterstock)
Πώς να γράψω μια ιοντική εξίσωση;
Πριν γράψουμε μια ιοντική εξίσωση, πρέπει να γνωρίζουμε τι είναι οι ιοντικές ενώσεις και πώς λειτουργούν.
Οι ιοντικές ενώσεις αποτελούνται από αντίθετα φορτισμένα ιόντα (άτομο ή μόριο με καθαρό φορτίο) που συγκρατούνται μεταξύ τους με ηλεκτροστατική δύναμη. Αυτές οι ενώσεις διασπώνται στα συστατικά τους ιόντα όταν διαλύονται σε κατάλληλο διαλύτη. Όταν το νερό χρησιμοποιείται ως διαλύτης, το διάλυμα ονομάζεται υδατικό διάλυμα (το νερό είναι πολύ καλός διαλύτης και λειτουργεί για τις περισσότερες ιοντικές ενώσεις). Μπορεί να έχετε δει αυτές τις λύσεις με την ένδειξη aq στις χημικές εξισώσεις.
Τα ιόντα που έχουν διαχωριστεί στη συνέχεια αντιδρούν με ιόντα άλλων αντιδρώντων και δίνουν τελικά προϊόντα.
Ωστόσο, ορισμένα ιόντα υπάρχουν και στις δύο πλευρές μιας χημικής εξίσωσης και δεν συμμετέχουν άμεσα στην αντίδραση. Αυτά τα ιόντα είναι γνωστά ως ιόντα θεατών (περισσότερα για αυτά αργότερα).
Τώρα, ας μάθουμε πώς να γράφουμε μια καθαρή ιοντική εξίσωση.
Βήμα 1:Ισορροπήστε τη χημική εξίσωση.
Μια καθαρή ιοντική εξίσωση προέρχεται από μια ισορροπημένη χημική εξίσωση, επομένως πρέπει να έχουμε μια ισορροπημένη χημική εξίσωση πριν συνεχίσουμε.
Για να εξισορροπήσετε μια χημική εξίσωση, ξεκινήστε μετρώντας τον αριθμό των ατόμων κάθε στοιχείου και στις δύο πλευρές της εξίσωσης. Αφού ληφθούν υπόψη όλα τα άτομα, ξεκινήστε με την εξισορρόπηση των πρωτογενών στοιχείων, ακολουθούμενα από τα άτομα υδρογόνου και οξυγόνου.
Εάν αυτή η σύντομη περιγραφή για το πώς να εξισορροπήσετε μια χημική εξίσωση δεν έκανε αρκετά κλικ, προχωρήστε και δείτε το πιο λεπτομερές άρθρο μας σχετικά με αυτό το θέμα:πώς να γράψετε μια ισορροπημένη χημική εξίσωση
Για παράδειγμα, η ισορροπημένη χημική εξίσωση για την αντίδραση χλωριούχου καλίου με νιτρικό μόλυβδο είναι:
2KCL + Pb(NO3)2 → 2KNO3 + PbCl2
Βήμα 2:Προσδιορισμός των φυσικών καταστάσεων όλων των αντιδρώντων και προϊόντων
Τώρα, πρέπει να προσδιορίσουμε τη φυσική κατάσταση κάθε συμμετέχοντος αντιδρώντος και προϊόντος στην εξίσωση. Για το σκοπό αυτό, χρησιμοποιούμε τον περιοδικό πίνακα και τον πίνακα διαλυτότητας. Ο πίνακας διαλυτότητας εμφανίζει διάφορα ανιόντα και κατιόντα και πώς θα συμπεριφέρονται οι συνδυασμοί αυτών των δύο σωματιδίων στο νερό.
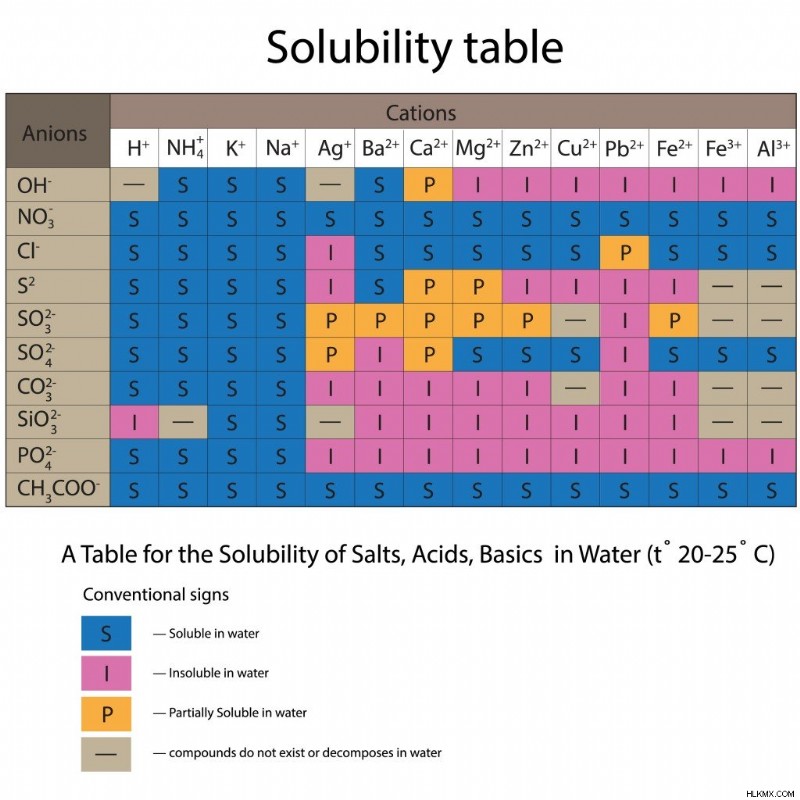
Πίνακας διαλυτότητας για διάφορα ανιόντα και κατιόντα στο νερό. (Φωτογραφία:yaruna/Shutterstock)
Εάν δεν είναι σαφές από τη δήλωση προβλήματος, ανατρέξτε στον περιοδικό πίνακα για να λάβετε τις φυσικές καταστάσεις των συμμετεχόντων στη στοιχειώδη τους μορφή. Για τις ενώσεις (και τα άλατα), εάν περιλαμβάνονται στα διαλύματα, ξεκινήστε ελέγχοντας τη διαλυτότητά τους στον πίνακα διαλυτότητας. Εάν είναι διαλυτά, προχωρήστε και γράψτε τις καταστάσεις τους ως υδατικές. Εάν η ένωση δεν είναι διαλυτή, πρέπει να υπάρχει σε στερεή κατάσταση. Επίσης, οποιοδήποτε οξύ ή βάση εμπλέκεται στην αντίδραση θα είναι υδατικό.
Από τον πίνακα διαλυτότητας, βλέπουμε ότι τα κατιόντα K+ είναι διαλυτά στο νερό με ανιόντα Cl– και NO3–. Έτσι, οι ενώσεις KCL και KNO3 είναι υδατικές. Όσο για τα κατιόντα Pb2+, είναι διαλυτά με ανιόντα NO3-, αλλά μόνο μερικώς διαλυτά με ανιόντα Cl-. Έτσι, το Pb(NO3)2 είναι υδατικό, ενώ το PbCl2 υπάρχει ως στερεό.
Γράφοντας την ισορροπημένη χημική εξίσωση με τις φυσικές καταστάσεις κάθε αντιδρώντος και προϊόντος, έχουμε:
2KCL(aq) + Pb(NO3)2 (aq) → 2KNO3 (aq) + PbCl2 (s)
Βήμα 3:Διασπάστε τις υδατικές ενώσεις στα συστατικά τους ιόντα
Για να γράψουμε μια ιοντική εξίσωση, θα χρειαστεί τώρα να διασπάσουμε τις υδατικές ενώσεις στα συστατικά τους ιόντα. Θυμηθείτε να διασπάσετε μόνο τις υδατικές ενώσεις, καθώς αυτές είναι διαλυτές στο νερό και θα διασπαστούν στα συστατικά τους ιόντα. Αφήστε τους μη υδατικούς συμμετέχοντες ως έχουν.
Όσον αφορά το παράδειγμά μας, το KCL θα διασπαστεί σε ιόντα K+ και Cl–, ενώ το Pb(NO3)2 θα διασπαστεί σε Pb2+ και 2NO3– στην πλευρά του αντιδρώντος.
Από την πλευρά του προϊόντος, το KNO3 θα διαχωριστεί σε ιόντα K+ και NO3–. Ως στερεό, το PbCl2 θα παραμείνει ως έχει.
2K+(aq) + 2Cl–(aq) + Pb2+(aq) + 2NO3 – (aq) → 2K+(aq) + 2NO3 –(aq) + PbCl2 (s)
Σημείωση: Μην ξεχάσετε να πολλαπλασιάσετε κάθε ιόν με τον στοιχειομετρικό συντελεστή με τον οποίο επικολλήθηκε στην ισορροπημένη χημική εξίσωση. Εάν δεν το κάνετε αυτό, τα ιόντα και τα φορτία τους θα είναι μη ισορροπημένα.
Βήμα 4:Αφαιρέστε τα ιόντα θεατών
Τώρα, για το τελευταίο βήμα, και για να γράψουμε την καθαρή ιοντική εξίσωση, το μόνο που χρειάζεται να κάνουμε είναι να αφαιρέσουμε τα ιόντα θεατή. Όπως αναφέρθηκε προηγουμένως, όταν οι ιοντικές ενώσεις διασπώνται στα ιόντα τους, μόνο μερικές από αυτές αντιδρούν με άλλα ιόντα για να σχηματίσουν προϊόντα, ενώ άλλες κάθονται πίσω και τις παρακολουθούν να αντιδρούν. Όπως και οι θεατές σε ένα αθλητικό γεγονός, αυτά τα ιόντα δεν συμμετέχουν άμεσα στην αντίδραση, αλλά απλώς βλέπουν, και έτσι ονομάζονται ιόντα θεατών. Τα ιόντα που αντιδρούν με άλλα ιόντα για να σχηματίσουν προϊόντα μπορεί να ονομάζονται κύρια ιόντα ή ιόντα παίκτη.

Τα ιόντα θεατών παρόμοια με τους θεατές δεν συμμετέχουν σε μια χημική αντίδραση.
Τα ιόντα θεατή εμφανίζονται αμετάβλητα τόσο στην πλευρά του αντιδρώντος όσο και στην πλευρά του προϊόντος μιας χημικής εξίσωσης. Μερικά από τα πιο κοινά ιόντα θεατών περιλαμβάνουν τα αλκαλικά μέταλλα της πρώτης στήλης στον περιοδικό πίνακα (K+ &Na+) και αλογόνα, όπως Cl– &F–. Δεδομένου ότι αυτά τα ιόντα δεν συμμετέχουν στην αντίδραση, δεν επηρεάζουν επίσης την ισορροπία.
Για την αντίδραση του χλωριούχου καλίου με το νιτρικό μόλυβδο, τα ιόντα K+ και NO3– είναι παρόντα και αμετάβλητα και στις δύο πλευρές. αυτά είναι τα ιόντα του θεατή. Τα ιόντα Cl– και Pb2+ σχηματίζουν το τελικό προϊόν PbCl2 και είναι τα ιόντα παίκτη. Απλά ακυρώστε τα K+ και NO3– και ξαναγράψτε την εξίσωση με τους υπόλοιπους συμμετέχοντες για να λάβετε την καθαρή ιοντική εξίσωση.
2K+ (aq) + 2Cl–(aq) + Pb2+(aq) + 2NO3 – (aq) → 2K+ (aq) + 2NO3 – (aq) + PbCl2 (s)
Κατά την επανεγγραφή της εξίσωσης, έχουμε:
2Cl–(aq) + Pb2+(aq) → PbCl2 (s)
Μετά την αναδιάταξη των αντιδρώντων, η εξίσωση είναι:
Pb2+(aq) + 2Cl–(aq) → PbCl2 (s)
Η παραπάνω εξίσωση ονομάζεται καθαρή ιοντική εξίσωση για την αντίδραση του χλωριούχου καλίου με το νιτρικό μόλυβδο, από το οποίο προκύπτει χλωριούχο κάλιο ως πρωτεύον προϊόν.
Τελικές λέξεις
Η σύνταξη μιας καθαρής ιοντικής εξίσωσης από μόνη της δεν είναι δύσκολη, αλλά απαιτεί γνώση διαφόρων θεμάτων. Αυτά περιλαμβάνουν υδατικά διαλύματα, ιοντικές ενώσεις, τη διαλυτότητα διαφόρων ενώσεων και τον τρόπο χρήσης του πίνακα διαλυτότητας, μεταξύ άλλων.
Μια λανθασμένα ισορροπημένη χημική εξίσωση στην αρχή αυτής της διαδικασίας σίγουρα θα σας οδηγήσει σε λάθος μονοπάτι. Επομένως, φροντίστε να ξεκινήσετε με μια τέλεια ισορροπημένη χημική εξίσωση.
Ομοίως, όταν γράφετε την ιοντική μορφή, βεβαιωθείτε ότι ο αριθμός των ιόντων και τα φορτία τους είναι ισορροπημένα και στις δύο πλευρές της εξίσωσης πριν ακυρώσετε τα ιόντα θεατών για να φτάσετε στην τελική ιοντική εξίσωση.




