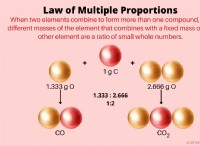
Γιατί η σθένος του άνθρακα δεν επεκτείνεται πέρα από τέσσερα;
* Ηλεκτρονική διαμόρφωση: Ο άνθρακας έχει ηλεκτρονική διαμόρφωση του 1S2 2S2 2P2. Αυτό σημαίνει ότι έχει τέσσερα ηλεκτρόνια σθένους στο δεύτερο κέλυφος (2s και 2p τροχιακά).
* υβριδοποίηση: Ο άνθρακας υφίσταται υβριδοποίηση SP³, όπου τα 2s τροχιακά μίγματα με τα τρία 2p τροχιακά για να σχηματίσουν τέσσερα ισοδύναμα υβριδικά τροχιακά SP³. Αυτά τα υβριδικά τροχιακά δείχνουν προς τις γωνίες ενός τετράεδρου, επιτρέποντας στον άνθρακα να σχηματίζει τέσσερις μεμονωμένους δεσμούς με άλλα άτομα.
* Orbital αλληλεπικάλυψη: Τα υβριδικά τροχιακά SP³ είναι τέλεια προσανατολισμένα για μέγιστη επικάλυψη με τροχιακά άλλα άτομα, οδηγώντας σε ισχυρούς δεσμούς Sigma.
* Ενεργειακές εκτιμήσεις: Ενώ θεωρητικά, ο άνθρακας θα μπορούσε ενδεχομένως να διαμορφώσει περισσότερους από τέσσερις δεσμούς, αυτό θα απαιτούσε τη χρήση τροχιακών τροχών υψηλότερης ενέργειας, τα οποία είναι ενεργά δυσμενή.
* Κανόνας οκτάδων: Ο κανόνας οκτώ (τάση των ατόμων για την επίτευξη σταθερής διαμόρφωσης με οκτώ ηλεκτρόνια στο εξώτατο κέλυφος τους) ικανοποιείται όταν ο άνθρακας σχηματίζει τέσσερις δεσμούς, με αποτέλεσμα μια σταθερή διαμόρφωση.
Επομένως, η ικανότητα του άνθρακα να σχηματίζει τέσσερις δεσμούς είναι συνέπεια της ηλεκτρονικής διαμόρφωσης, της υβριδοποίησης, της τροχιακής επικάλυψης, των ενεργειακών παραμέτρων και του κανόνα οκτάτων. Ενώ υπάρχουν εξαιρέσεις από τον κανόνα των οκτάδων, όπως στην περίπτωση των εκτεταμένων οκτάδων σε μεγαλύτερα άτομα, η περιορισμένη ομοιοπολιτική ομοιόμορφη είναι μια καθιερωμένη αρχή στη χημεία.