Ποιο μόριο έχει μόνιμη διπολική στιγμή;
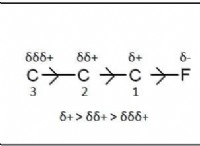
1. Το μόριο περιέχει πολικούς δεσμούς:
* Ένας πολικός δεσμός σχηματίζεται μεταξύ δύο ατόμων με διαφορετική ηλεκτροαρνητικότητα (τάση να προσελκύει ηλεκτρόνια). Το πιο ηλεκτροαρνητικό άτομο τραβά τα κοινά ηλεκτρόνια πιο κοντά, δημιουργώντας ένα μερικό αρνητικό φορτίο σε αυτό το άτομο και ένα μερικό θετικό φορτίο στο λιγότερο ηλεκτροαρνητικό άτομο.
2. Η μοριακή γεωμετρία είναι ασύμμετρη:
* Ακόμη και αν ένα μόριο περιέχει πολικούς δεσμούς, οι διπολικές στιγμές αυτών των δεσμών μπορούν να ακυρώσουν εάν το μόριο έχει συμμετρική γεωμετρία. Για παράδειγμα, το CO2 είναι γραμμικό με δύο πολικούς C =O δεσμούς, αλλά τα διπόλια ακυρώνονται, με αποτέλεσμα ένα μη πολικό μόριο.
Παραδείγματα μορίων με μόνιμες διπολικές στιγμές:
* νερό (H2O): Το λυγισμένο σχήμα και οι πολικοί δεσμοί O-H οδηγούν σε μια καθαρή διπολική στιγμή.
* αμμωνία (NH3): Το τριγωνικό πυραμιδικό σχήμα και οι πολικοί δεσμοί Ν-Η δημιουργούν μια διπολική στιγμή.
* Χλωρίδιο υδρογόνου (HCl): Ο πολικός δεσμός H-CR έχει ως αποτέλεσμα μια διπολική στιγμή.
* αιθανόλη (CH3CH2OH): Ο πολικός δεσμός Ο-Η και η συνολική ασύμμετρη δομή οδηγούν σε μια διπολική στιγμή.
Παραδείγματα μορίων χωρίς μόνιμες διπολικές στιγμές:
* διοξείδιο του άνθρακα (CO2): Το γραμμικό σχήμα ακυρώνει τα δίπολα των δεσμών πολικών C =o.
* μεθάνιο (CH4): Η τετραεδρική γεωμετρία με τέσσερις ταυτόσημους δεσμούς C-H έχει ως αποτέλεσμα ένα συμμετρικό μόριο.
* Βενζόλιο (C6H6): Η συμμετρική δομή δακτυλίου με εναλλασσόμενους διπλούς δεσμούς ακυρώνει τις στιγμές του διπόλου.
Σημείωση:
* Η παρουσία μιας διπολικής ροπής είναι ένας βασικός παράγοντας που καθορίζει τις φυσικές ιδιότητες μιας ουσίας, συμπεριλαμβανομένου του σημείου τήξης, του σημείου βρασμού και της διαλυτότητας.
* Η διπολική στιγμή είναι μια ποσότητα φορέα, που σημαίνει ότι έχει τόσο μέγεθος όσο και κατεύθυνση.