Πώς σχηματίζονται οι ενώσεις σε ομοιοπολικό δεσμό;
Ο ομοιοπολικός σχηματισμός δεσμών:Η κοινή χρήση είναι φροντίδα!
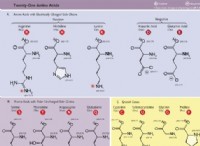
Οι ομοιοπολικοί δεσμοί σχηματίζονται όταν δύο ή περισσότερα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων, όπως αυτή ενός ευγενή αέριο. Δείτε πώς λειτουργεί:
1. ασταθή άτομα: Τα άτομα με ελλιπή εξωτερικά κελύφη (κέλυφος σθένους) είναι ασταθή. Λατρεύουν τη σταθερότητα ενός πλήρους εξωτερικού κελύφους.
2. Κοινή χρήση ηλεκτρονίων: Δύο ή περισσότερα άτομα μοιράζονται τα ηλεκτρόνια σθένους τους για να επιτύχουν ένα πλήρες εξωτερικό κέλυφος. Αυτή η κοινή χρήση δημιουργεί ένα κοινόχρηστο ζεύγος ηλεκτρονίων .
3. ομοιοπολικός δεσμός: Το κοινό ζεύγος ηλεκτρονίων συγκρατεί τα άτομα μαζί, σχηματίζοντας ένα ομοιοπολικό δεσμό .
Παράδειγμα:νερό (h₂o)
* υδρογόνο (h): Έχει 1 ηλεκτρόνιο σθένους. Χρειάζεται 1 ακόμη ηλεκτρόνιο για να γεμίσει το εξωτερικό κέλυφος του.
* οξυγόνο (o): Έχει 6 ηλεκτρόνια σθένους. Χρειάζεται 2 ακόμη ηλεκτρόνια για να γεμίσει το εξωτερικό κέλυφος του.
* σχηματισμός δεσμών:
* Δύο άτομα υδρογόνου μοιράζονται το ενιαίο ηλεκτρόνιο τους με το άτομο οξυγόνου.
* Το Oxygen μοιράζεται δύο από τα δικά του ηλεκτρόνια, ένα με κάθε άτομο υδρογόνου.
* Αυτό δημιουργεί δύο κοινά ζεύγη ηλεκτρονίων, σχηματίζοντας δύο ομοιοπολικούς δεσμούς.
* Κάθε άτομο έχει τώρα ένα πλήρες εξωτερικό κέλυφος, επιτυγχάνοντας σταθερότητα.
Τύποι ομοιοπολικών δεσμών:
* Ενιαίος ομοιοπολικός δεσμός: Ένα κοινό ζεύγος ηλεκτρονίων μεταξύ δύο ατόμων.
* Διπλός ομοιοπολικός δεσμός: Δύο κοινόχρηστα ζεύγη ηλεκτρονίων μεταξύ δύο ατόμων.
* τριπλός ομοιοπολικός δεσμός: Τρία κοινά ζεύγη ηλεκτρονίων μεταξύ δύο ατόμων.
Βασικά χαρακτηριστικά των ομοιοπολικών ενώσεων:
* Μοριακή δομή: Οι ομοιοπολικές ενώσεις υπάρχουν ως διακριτά μόρια, με σταθερές αναλογίες ατόμων.
* χαμηλότερα σημεία τήξης και βρασμού: Σε σύγκριση με τις ιοντικές ενώσεις, έχουν γενικά χαμηλότερα σημεία τήξης και βρασμού.
* Μη αγωγή: Οι ομοιοπολικές ενώσεις είναι γενικά κακοί αγωγοί ηλεκτρικής ενέργειας, τόσο σε στερεές όσο και σε υγρές καταστάσεις.
* ποικιλία ιδιοτήτων: Οι ομοιοπολικές ενώσεις μπορούν να είναι αέρια, υγρά ή στερεά και παρουσιάζουν ένα ευρύ φάσμα ιδιοτήτων ανάλογα με τη δομή και τη συγκόλληση του μορίου.
Συνοπτικά, σχηματίζονται ομοιοπολικοί δεσμοί όταν τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν σταθερότητα, δημιουργώντας μόρια με μοναδικές ιδιότητες.