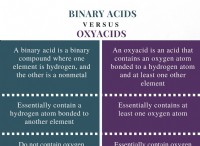
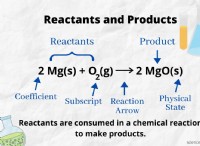
Γιατί υπάρχει έλξη μεταξύ μορίων οξέος και μορίων νερού;
1. Δεσμός υδρογόνου:
* Μόρια οξέος: Τα οξέα συνήθως έχουν ένα άτομο υδρογόνου συνδεδεμένο με ένα πολύ ηλεκτροαρνητικό άτομο όπως το οξυγόνο (π.χ. σε καρβοξυλικά οξέα) ή το άζωτο (π.χ. σε αμίνες). Αυτό δημιουργεί έναν πολικό δεσμό όπου το άτομο υδρογόνου φέρει ένα μερικό θετικό φορτίο (Δ+) και το ηλεκτροαρνητικό άτομο φέρει μερικό αρνητικό φορτίο (Δ-).
* Μόρια νερού: Το νερό είναι επίσης ένα πολύ πολικό μόριο λόγω της ηλεκτροαρνητικότητας του οξυγόνου. Το άτομο οξυγόνου έχει δύο μοναχικά ζεύγη ηλεκτρονίων, δίνοντάς του ένα μερικό αρνητικό φορτίο (Δ-), ενώ τα άτομα υδρογόνου έχουν μερικό θετικό φορτίο (δ+).
* αλληλεπίδραση: Το μερικό θετικό φορτίο στο άτομο υδρογόνου του μορίου οξέος μπορεί να σχηματίσει δεσμό υδρογόνου με τα ζεύγη μοναχικών στο άτομο οξυγόνου του μορίου νερού. Αυτή η αλληλεπίδραση είναι σχετικά ισχυρή και συμβάλλει σημαντικά στην έλξη μεταξύ μορίων οξέος και νερού.
2. Αλληλεπιδράσεις ιόντων-διπολικών:
* διάσπαση οξέος: Όταν ένα οξύ διαλύεται στο νερό, δωρίζει ένα πρωτόνιο (Η+) σε ένα μόριο νερού, σχηματίζοντας ένα ιόν υδρονίου (Η3Ο+) και ένα ανιόν (π.χ., Cl- για υδροχλωρικό οξύ).
* αλληλεπιδράσεις ιόντων-διπόλης: Το ιόν υδρονίου (Η3Ο+), το οποίο είναι εξαιρετικά φορτισμένο, μπορεί να σχηματίσει ισχυρές αλληλεπιδράσεις ιόντων-δίπολας με τα πολικά μόρια νερού. Παρομοίως, το ανιόν που σχηματίζεται από το όξινο μόριο αλληλεπιδρά επίσης με τα μόρια του νερού μέσω αλληλεπιδράσεων ιόντων-διπολικών.
3. Ηλεκτροστατικές αλληλεπιδράσεις:
* πολικότητα: Τόσο τα όξινα όσο και τα μόρια του νερού είναι πολικά, οδηγώντας σε ελκυστικές ηλεκτροστατικές αλληλεπιδράσεις μεταξύ των αντίθετα φορτισμένων περιοχών τους.
Συνολικά:
Ο συνδυασμός της δέσμευσης υδρογόνου, των αλληλεπιδράσεων ιόντων-διπολικών και των ηλεκτροστατικών αλληλεπιδράσεων καθιστά σημαντική την έλξη μεταξύ των μορίων οξέος και νερού. Αυτή η έλξη είναι η κινητήρια δύναμη πίσω από τη διάλυση των οξέων στο νερό, καθώς οι αλληλεπιδράσεις μεταξύ των μορίων οξέος και νερού ξεπερνούν τις δυνάμεις που συγκρατούν τα όξινα μόρια μαζί.
Σημείωση: Η αντοχή της έλξης μεταξύ μορίων οξέος και νερού ποικίλλει ανάλογα με το συγκεκριμένο οξύ και τη αντοχή του. Τα ισχυρά οξέα όπως το HCl διαχωρίζονται πλήρως στο νερό, οδηγώντας σε ισχυρές αλληλεπιδράσεις με μόρια νερού. Τα ασθενέστερα οξέα όπως το οξικό οξύ (CH3COOH) διαχωρίζονται εν μέρει, με αποτέλεσμα ασθενέστερες αλληλεπιδράσεις με μόρια νερού.