Οι μοριακές ενώσεις χαμηλού μοριακού βάρους τείνουν να είναι αέρια σε θερμοκρασία δωματίου που τα ακόλουθα είναι πιθανότατα όχι θερμοκρασία αερίου;
* Οι ενώσεις χαμηλού μοριακού βάρους είναι αέρια σε θερμοκρασία δωματίου: Αυτός είναι ένας γενικός κανόνας. Τα μικρότερα μόρια έχουν ασθενέστερες ενδομοριακές δυνάμεις (τις δυνάμεις που τους κρατούν μαζί), καθιστώντας τους πιο πιθανό να είναι στην αέρια κατάσταση σε θερμοκρασία δωματίου.
* Προσδιορισμός της εξαίρεσης: Για να βρείτε την ένωση που δεν είναι * πιθανό να είναι ένα αέριο, αναζητήστε ένα με σχετικά υψηλό μοριακό βάρος.
Ας εξετάσουμε μερικά παραδείγματα:
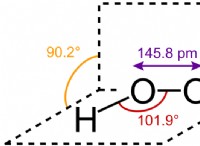
* νερό (h₂o): Μοριακό βάρος 18 g/mol. Το νερό είναι υγρό σε θερμοκρασία δωματίου, όχι αέριο. Αυτό οφείλεται στην ισχυρή σύνδεση υδρογόνου μεταξύ των μορίων νερού.
* μεθάνιο (ch₄): Μοριακό βάρος 16 g/mol. Το μεθάνιο είναι ένα αέριο σε θερμοκρασία δωματίου.
* αζώτου (n₂): Μοριακό βάρος 28 g/mol. Το άζωτο είναι ένα αέριο σε θερμοκρασία δωματίου.
* οξυγόνο (o₂): Μοριακό βάρος 32 g/mol. Το οξυγόνο είναι ένα αέριο σε θερμοκρασία δωματίου.
Ως εκ τούτου, η ένωση πιθανότατα να μην είναι αέριο σε θερμοκρασία δωματίου είναι νερό (h₂o).