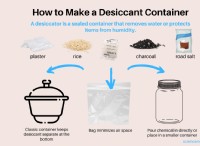
Ποια είναι η χημική αντίδραση που εμφανίζεται στην ηλεκτρόλυση;
1. Η ρύθμιση:
* ηλεκτρολύτης: Μια ουσία που διεξάγει ηλεκτρική ενέργεια λόγω της παρουσίας ιόντων (φορτισμένα άτομα ή μόρια). Αυτό θα μπορούσε να είναι ένα τετηγμένο άλας, ένα υδατικό διάλυμα, ή ακόμα και ένα στερεό.
* ηλεκτρόδια: Δύο αγώγιμα υλικά (συνήθως μέταλλα) βυθίζονται στον ηλεκτρολύτη. Το ένα συνδέεται με τον θετικό τερματικό μιας πηγής ενέργειας (ανόδου), ο άλλος στον αρνητικό τερματικό (κάθοδος).
2. Η αντίδραση:
* Στην άνοδο: Εμφανίζεται η οξείδωση. Αυτό σημαίνει ότι τα ηλεκτρόνια χάνονται, με αποτέλεσμα μια θετική αύξηση του φορτίου στο είδος στην άνοδο. Συνήθως, αυτό συνεπάγεται την απώλεια ηλεκτρονίων από ιόν ή άτομο στον ηλεκτρολύτη, σχηματίζοντας κατιόν (θετικό ιόν) ή ουδέτερο μόριο.
* στην καθόβα: Συμβαίνει μείωση. Αυτό σημαίνει ότι τα ηλεκτρόνια κερδίζονται, με αποτέλεσμα τη μείωση του θετικού φορτίου ή την αύξηση του αρνητικού φορτίου. Τα ηλεκτρόνια από την εξωτερική πηγή ενέργειας μεταφέρονται στο είδος της καθόδου, σχηματίζοντας ένα ανιόν (αρνητικό ιόν) ή ένα ουδέτερο μόριο.
3. Η συνολική διαδικασία:
* Το ηλεκτρικό ρεύμα οδηγεί την κίνηση των ιόντων στον ηλεκτρολύτη, επιτρέποντας ταυτόχρονα τις αντιδράσεις οξείδωσης και μείωσης. Αυτές οι αντιδράσεις συνοδεύονται συνήθως από την απελευθέρωση αερίων ή από τον σχηματισμό νέων χημικών ενώσεων.
Παράδειγμα:ηλεκτρόλυση νερού
* ηλεκτρολύτης: Νερό (h₂o)
* Άνοψη: Τα μόρια του νερού οξειδώνονται, σχηματίζουν αέριο οξυγόνου (ΟΟ) και απελευθερώνουν ιόντα υδρογόνου (Η+):
* 2H₂O → O₂ + 4H + + 4E-
* Καθεάνα: Τα ιόντα υδρογόνου μειώνονται, σχηματίζοντας αέριο υδρογόνου (H₂):
* 4H + + 4E- → 2H₂
* Συνολική αντίδραση:
* 2H₂O → 2H₂ + O₂
Βασικά σημεία που πρέπει να θυμάστε:
* Η κατεύθυνση της χημικής αντίδρασης υπαγορεύεται από τη ροή του ηλεκτρικού ρεύματος, σε αντίθεση με μια αυθόρμητη χημική αντίδραση που προχωρά με βάση την ελεύθερη ενέργεια του Gibbs.
* Η ηλεκτρόλυση είναι μια ευέλικτη τεχνική που χρησιμοποιείται σε ένα ευρύ φάσμα εφαρμογών, συμπεριλαμβανομένης της παραγωγής χλωρίου, υδροξειδίου του νατρίου, αλουμινίου και υδρογόνου.
Επιτρέψτε μου να ξέρω αν θέλετε να εξερευνήσετε συγκεκριμένα παραδείγματα ή να συζητήσετε έναν συγκεκριμένο τύπο ηλεκτρόλυσης!