Πώς να φτιάξετε έναν σπιτικό ξηραντήρα – δοχείο αποξηραντικού
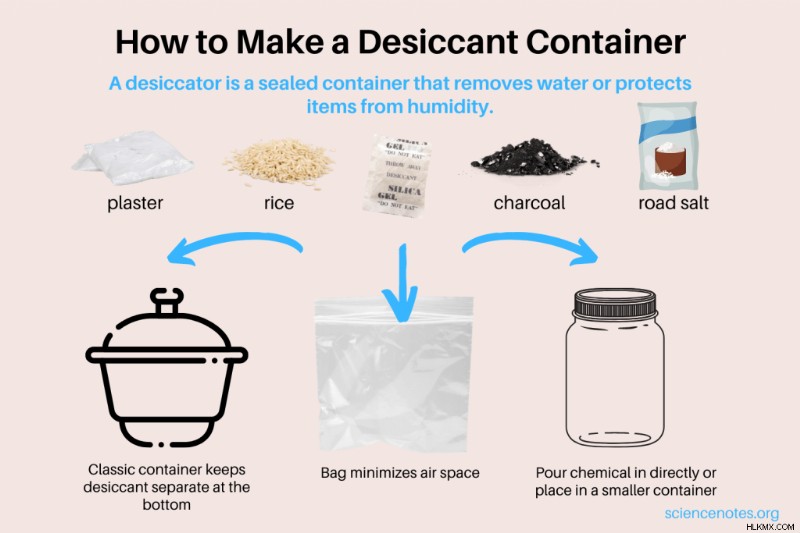
Είναι εύκολο να φτιάξεις έναν σπιτικό ξηραντήρα για να προστατεύει τα αντικείμενα από την υγρασία και να απομακρύνει την υγρασία από αυτά που βραχούν. Για παράδειγμα, χρησιμοποιήστε ένα δοχείο ξηραντικού για να στεγνώσετε ένα υγρό κινητό τηλέφωνο, να διατηρήσετε τα κράκερ τραγανά και να προστατέψετε τα υφάσματα από τη μούχλα ή το ωίδιο. Δείτε πώς φτιάχνετε έναν ξηραντήρα και μια ματιά στα άμεσα διαθέσιμα ξηραντικά και τις χρήσεις τους.
Τι είναι ο ξηραντήρας;
Σε ένα εργαστήριο, ένας ξηραντήρας είναι συνήθως ένα μεγάλο κομμάτι γυάλινο σκεύος που αποτελείται από μερικά βασικά μέρη.
- Κάτω τμήμα που περιέχει ξηραντικό.
- Διάτρητο διαχωριστικό που διαχωρίζει τη χημική ουσία από το άλλο περιεχόμενο ξηραντήρα.
- Καπάκι που σφραγίζει. Συχνά, αυτό είναι ένα γυάλινο καπάκι που σφραγίζει χρησιμοποιώντας γράσο κενού.
- Μερικοί ξηραντήρες διαθέτουν στρόφιγγα που σας επιτρέπει να αντλείτε μερικό κενό.
Αυτές οι συσκευές διατηρούν τα ευαίσθητα στην υγρασία αντικείμενα ή αφαιρούν την υπολειμματική υγρασία από σχεδόν στεγνά αντικείμενα. Κοινές χημικές ουσίες ξηραντήρα είναι η γέλη πυριτίου, ο πυρωμένος ασβέστης, το θειικό ασβέστιο (Drierite) ή το χλωριούχο ασβέστιο.
Αποξηραντικά και οι χρήσεις τους
Τα αποξηραντικά είναι υγροσκοπικά χημικά. Ευτυχώς, αυτά που χρησιμοποιούν οι επιστήμονες σε εργαστηριακό περιβάλλον είναι επίσης άμεσα διαθέσιμα ως κοινά οικιακά χημικά.
- Χάντρες γέλης πυριτίου
- Ενεργός άνθρακας
- Χλωριούχο ασβέστιο (αλάτι του δρόμου ή στερεό λευκαντικό)
- Θειικό ασβέστιο (σοβάς Παρισιού ή γύψου)
- Ζεόλιθος
- Ρύζι
- Επιτραπέζιο αλάτι (χλωριούχο νάτριο)
- Πηλός μπεντονίτη (από κατάστημα κηπουρικής ή ως απορρίμματα γατούλων)
- Ζάχαρη (σακχαρόζη)
- Θειικό μαγνήσιο (άλας Epsom)
- Quick lime (οξείδιο του ασβεστίου)
- Υδροξείδιο του νατρίου ή υδροξείδιο του καλίου (καθαριστικό αλυσίδων ή στερεών αποχετεύσεων)
Ποια χημική ουσία χρησιμοποιείτε εξαρτάται από τη διαθεσιμότητα και τη χρήση για την οποία προορίζετε. Το silica gel και ο ενεργός άνθρακας είναι ασφαλή ξηραντικά γενικής χρήσης. Μερικά αποξηραντικά είναι ασφαλή για χρήση γύρω από τα τρόφιμα. Για παράδειγμα, χρησιμοποιήστε ρύζι, αλάτι, ζάχαρη ή ενεργό άνθρακα για να διατηρηθεί το στεγνό και τραγανό.
Να είστε προσεκτικοί με το γρήγορο ασβέστη, το υδροξείδιο του νατρίου ή το υδροξείδιο του καλίου. Είναι ιδιαίτερα αποτελεσματικά, αλλά είναι καυστικά και μπορούν να προκαλέσουν χημικά εγκαύματα. Επίσης, να θυμάστε ότι το υδροξείδιο του νατρίου, το υδροξείδιο του καλίου και το χλωριούχο ασβέστιο διαλύονται τελικά στο νερό που απορροφούν. Για τις περισσότερες χρήσεις, ίσως είναι καλύτερα να επιλέξετε άλλη χημική ουσία από τη λίστα.
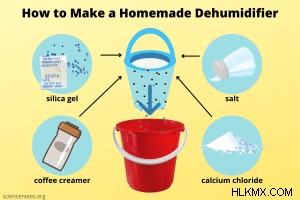
Φτιάξτε έναν Σπιτικό Αφυγραντήρα
Ένας σπιτικός αφυγραντήρας είναι σαν ξηραντήρας σε στεροειδή γιατί αφαιρεί την υγρασία από ένα ολόκληρο δωμάτιο. Δείτε τι κάνετε.
Φτιάξτε έναν ξηραντήρα
Η κατασκευή ενός ξηραντήρα είναι εξαιρετικά εύκολη. Το μόνο που κάνετε είναι να τοποθετήσετε μια μικρή ποσότητα ξηραντικού σε ένα δοχείο που μπορεί να σφραγιστεί.
- Πλαστική σακούλα με φερμουάρ
- Βάζο με καπάκι
Το πλεονέκτημα της χρήσης μιας πλαστικής σακούλας είναι ότι μπορείτε να διώξετε τον αέρα, ο οποίος περιέχει υδρατμούς. Το πλεονέκτημα της χρήσης ενός βάζου είναι ότι μπορείτε να εμποδίσετε το αφυγραντικό να έρθει σε επαφή με το αντικείμενο σας. Απλώς ρίξτε το ξηραντικό σε ένα μικρό πιάτο και τοποθετήστε το μέσα στο βάζο. Εναλλακτικά, ρίξτε τη χημική ουσία απευθείας στο βάζο, αλλά τοποθετήστε το προϊόν σας σε ένα μικρό πιάτο πάνω από το ξηραντικό.
Πώς να επαναφορτίσετε έναν ξηραντήρα
Τελικά, το ξηραντικό απορροφά ή απορροφά όλο το νερό που μπορεί να κρατήσει. Μια επιλογή είναι η αντικατάσταση των χημικών. Ωστόσο, μπορείτε να επαναφορτίσετε τα αποξηραντικά χημικά απομακρύνοντας το νερό. Κάνετε αυτό ρίχνοντας τη χημική ουσία σε ένα ταψί και ζεστάνετε το τηγάνι σε ζεστό από πάνω. Αφού κρυώσει, αποθηκεύστε το ξηρό χημικό σε ένα σφραγισμένο δοχείο μέχρι να είστε έτοιμοι να το χρησιμοποιήσετε.
Αναφορές
- Alexeyev, V. (2000). Ποσοτική ανάλυση . University Press of the Pacific. ISBN:0898750342.
- Chai, Christina Li Lin; Armarego, W. L. F. (2003). Καθαρισμός Εργαστηριακών Χημικών Προϊόντων . Οξφόρδη:Butterworth-Heinemann. ISBN 978-0-7506-7571-0.
- Flörke, Otto W., et al. (2008). "Silica" στην Ullmann's Encyclopedia of Industrial Chemistry . Weinheim:Wiley-VCH. doi:10.1002/14356007.a23_583.pub3
- Lavan, Z.; Monnier, Jean-Baptiste; Worek, W. Μ. (1982). «Ανάλυση Δεύτερου Νόμου Συστημάτων Ψύξης ξηραντικού». Journal of Solar Energy Engineering . 104 (3):229–236. doi:10.1115/1.3266307
- Williams, D. B. G.; Lawton, M. (2010). «Ξήρανση οργανικών διαλυτών:Ποσοτική αξιολόγηση της αποτελεσματικότητας αρκετών αποξηραντικών». The Journal of Organic Chemistry . 75:8351. doi:10.1021/jo101589h