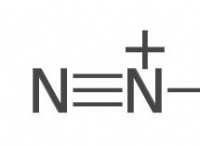
Πώς κερδίζουν τα μέταλλα ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων σε ιοντική συγκόλληση;
* Τα μέταλλα έχουν λίγα ηλεκτρόνια σθένους: Έχουν συνήθως 1, 2 ή 3 ηλεκτρόνια στο εξώτατο κέλυφος τους.
* Πλήρης σταθερότητα του εξωτερικού κελύφους: Τα άτομα είναι πιο σταθερά όταν έχουν ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων.
* απώλεια ηλεκτρόνων: Τα μέταλλα επιτυγχάνουν ένα πλήρες εξωτερικό κέλυφος χάνοντας τα ηλεκτρόνια σθένους τους. Αυτό τους αφήνει με θετικό φορτίο, σχηματίζοντας ένα κατιόν.
Παράδειγμα: Το νάτριο (Na) έχει ένα ηλεκτρόνιο σθένους. Χάσοντας αυτό το ηλεκτρόνιο, γίνεται ένα ιόν νατρίου (Na+) με ένα πλήρες εξωτερικό κέλυφος όπως το Neon Neon (NE).
Ιονική σύνδεση: Τα χαμένα ηλεκτρόνια από το μέταλλο στη συνέχεια μεταφέρονται σε μη μέταλλο άτομο, το οποίο πρέπει να κερδίσει ηλεκτρόνια για να επιτύχει ένα πλήρες εξωτερικό κέλυφος. Αυτό δημιουργεί μια ηλεκτροστατική έλξη μεταξύ του θετικά φορτισμένου μεταλλικού ιόντος και του αρνητικά φορτισμένου μη μεταλλικού ιόντος, σχηματίζοντας ένα ιοντικό δεσμό.
Βασικά σημεία που πρέπει να θυμάστε:
* Μέταλλα * Χάνετε * ηλεκτρόνια για να επιτύχετε ένα πλήρες εξωτερικό κέλυφος.
* Μη μέταλλα * κέρδος * ηλεκτρόνια για να επιτύχετε ένα πλήρες εξωτερικό κέλυφος.
* Οι αντίθετες χρεώσεις των προκύπτουσων ιόντων προσελκύουν, σχηματίζοντας ένα ιοντικό δεσμό.