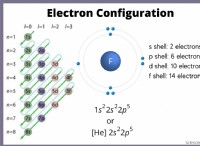
Όταν το υδρογόνο είναι προσαρτημένο στο πιο εξαιρετικά ελιγμικό άτομο οξυγόνου σε ένα μόριο νερού;
Εδώ είναι γιατί:
* Ηλεκτροργατιστικότητα: Το οξυγόνο είναι περισσότερο ηλεκτροαρνητικό από το υδρογόνο. Αυτό σημαίνει ότι το οξυγόνο έχει ισχυρότερη έλξη για ηλεκτρόνια σε χημικό δεσμό.
* πολικός ομοιοπολικός δεσμός: Σε ένα μόριο νερού (H₂O), τα κοινόχρηστα ηλεκτρόνια στους δεσμούς H-O περνούν περισσότερο χρόνο πιο κοντά στο άτομο οξυγόνου. Αυτό δημιουργεί ένα μερικό αρνητικό φορτίο (δ-) για το οξυγόνο και μερική θετική φορτία (δ+) στα άτομα υδρογόνου.
* πολικότητα: Η ανομοιόμορφη κατανομή των ηλεκτρονίων στο μόριο του νερού το καθιστά ένα πολικό μόριο, με θετικό άκρο (πλευρά υδρογόνου) και αρνητικό άκρο (πλευρά οξυγόνου).
Έτσι, λόγω της υψηλότερης ηλεκτροαρνητικότητας του οξυγόνου, τα ηλεκτρόνια στο μόριο του νερού τραβούν προς το άτομο οξυγόνου, δημιουργώντας ένα μερικό αρνητικό φορτίο στο οξυγόνο.