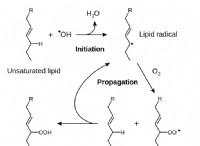
Γιατί το οξυγόνο θεωρείται εξαιρετικά ηλεκτροαρνητικό;
1. Μικρό ατομικό μέγεθος: Το οξυγόνο έχει μια μικρή ατομική ακτίνα, που σημαίνει ότι ο πυρήνας του είναι σχετικά κοντά στα ηλεκτρόνια σθένους. Αυτή η εγγύτητα έχει ως αποτέλεσμα μια ισχυρή έλξη μεταξύ του πυρήνα και των ηλεκτρονίων.
2. Υψηλό πυρηνικό φορτίο: Το οξυγόνο έχει υψηλό πυρηνικό φορτίο (8 πρωτόνια). Αυτό το ισχυρό θετικό φορτίο τραβάει τα αρνητικά φορτισμένα ηλεκτρόνια πιο έντονα, αυξάνοντας περαιτέρω την ηλεκτροαρνητικότητά του.
3. Υψηλό αποτελεσματικό πυρηνικό φορτίο: Το αποτελεσματικό πυρηνικό φορτίο που βιώνουν τα ηλεκτρόνια σθένους είναι ακόμη μεγαλύτερο σε οξυγόνο λόγω της παρουσίας μόνο δύο ηλεκτρόνων εσωτερικού κελύφους (2s) που προστατεύουν τα ηλεκτρόνια σθένους από τον πυρήνα.
4. Διαμόρφωση ηλεκτρονίων: Το οξυγόνο διαθέτει έξι ηλεκτρόνια σθένους, τα οποία είναι δύο λιγότερο από ένα πλήρες οκτάδες. Αυτή η διαμόρφωση ηλεκτρονίων καθιστά πολύ πρόθυμη να κερδίσει δύο ηλεκτρόνια για να επιτύχει μια σταθερή, ευγενή διαμόρφωση αερίου.
5. Υψηλή ενέργεια ιονισμού: Το οξυγόνο έχει υψηλή ενέργεια ιονισμού, υποδεικνύοντας ότι απαιτεί πολλή ενέργεια για την απομάκρυνση ενός ηλεκτρονίου. Αυτό ενισχύει την τάση του να προσελκύει ηλεκτρόνια και όχι να τα χάσει.
6. Υψηλή συγγένεια ηλεκτρονίων: Το οξυγόνο έχει υψηλή συγγένεια ηλεκτρονίων, που σημαίνει ότι απελευθερώνει μια σημαντική ποσότητα ενέργειας όταν κερδίζει ένα ηλεκτρόνιο. Αυτό υπογραμμίζει και πάλι την έντονη επιθυμία του να προσελκύσει ηλεκτρόνια.
Συνοπτικά: Το μικρό μέγεθος, το υψηλό πυρηνικό φορτίο του οξυγόνου, το υψηλό αποτελεσματικό πυρηνικό φορτίο, η διαμόρφωση ηλεκτρονίων, η ενέργεια υψηλής ιονισμού και η υψηλή συγγένεια ηλεκτρονίων συμβάλλουν στην εξαιρετικά ηλεκτροαρνητική φύση του. Αυτό καθιστά το οξυγόνο έναν ισχυρό ελκυστήρα ηλεκτρονίων σε χημικούς δεσμούς, με αποτέλεσμα μερικές αρνητικές χρεώσεις σε πολλά μόρια.