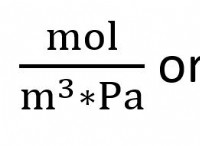Γιατί τα ηλεκτρόνια είναι σημαντικά στις χημικές αντιδράσεις;
* δεσμός: Τα ηλεκτρόνια εμπλέκονται στο σχηματισμό και το σπάσιμο των χημικών δεσμών. Τα άτομα μοιράζονται ή μεταφέρονται ηλεκτρόνια για να δημιουργήσουν σταθερά μόρια.
* ομοιοπολικοί δεσμοί: Τα άτομα μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση.
* Ιονικά ομόλογα: Ένα άτομο μεταφέρει ηλεκτρόνια σε ένα άλλο, δημιουργώντας αντίθετα φορτισμένα ιόντα που προσελκύουν.
* Αντιδραστικότητα: Ο αριθμός των ηλεκτρονίων στο εξώτατο κέλυφος ενός ατόμου (ηλεκτρόνια σθένους) καθορίζει πόσο αντιδραστικό είναι ένα άτομο. Τα άτομα με μη ζευγαρωμένα ηλεκτρόνια είναι πιο πιθανό να συμμετάσχουν σε αντιδράσεις.
* Μεταφορά ενέργειας: Τα ηλεκτρόνια μπορούν να απορροφήσουν ή να απελευθερώσουν ενέργεια, η οποία οδηγεί σε χημικές αντιδράσεις.
* Αντιδράσεις οξειδοαναγωγής: Αντιδράσεις όπου τα ηλεκτρόνια μεταφέρονται από ένα άτομο ή μόριο σε άλλο. Αυτή η μεταφορά συχνά έχει ως αποτέλεσμα την απελευθέρωση ή την απορρόφηση της ενέργειας.
* Κατάλυση: Τα ένζυμα, οι βιολογικοί καταλύτες, χρησιμοποιούν ηλεκτρόνια για να διευκολύνουν τις χημικές αντιδράσεις. Συχνά κρατούν προσωρινά τα ηλεκτρόνια, σταθεροποιώντας τα ενδιάμεσα και μειώνοντας το ενεργειακό φράγμα για να προχωρήσει η αντίδραση.
Συνοπτικά, τα ηλεκτρόνια είναι απαραίτητα για τις χημικές αντιδράσεις επειδή συμμετέχουν στον σχηματισμό και το σπάσιμο των δεσμών, καθορίζουν την αντιδραστικότητα και διευκολύνουν τη μεταφορά ενέργειας.
Ακολουθούν μερικά παραδείγματα για το πώς εμπλέκονται τα ηλεκτρόνια σε χημικές αντιδράσεις:
* καύση: Τα ηλεκτρόνια μεταφέρονται από μόρια καυσίμου (όπως υδρογονάνθρακες) σε μόρια οξυγόνου, απελευθερώνοντας ενέργεια ως θερμότητα και φως.
* φωτοσύνθεση: Τα ηλεκτρόνια χρησιμοποιούνται για τη μετατροπή της φωτεινής ενέργειας σε χημική ενέργεια με τη μορφή γλυκόζης.
* Κυτταρική αναπνοή: Τα ηλεκτρόνια περνούν κατά μήκος μιας αλυσίδας μορίων, απελευθερώνοντας ενέργεια που χρησιμοποιείται για την παραγωγή ΑΤΡ, το ενεργειακό νόμισμα των κυττάρων.
Η κατανόηση του ρόλου των ηλεκτρονίων στις χημικές αντιδράσεις είναι ζωτικής σημασίας για την κατανόηση του τρόπου με τον οποίο λειτουργεί ο κόσμος γύρω μας, από τις απλούστερες χημικές αντιδράσεις μέχρι τις πολύπλοκες βιολογικές διεργασίες.