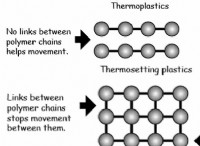
Γιατί τα μόρια έχουν διαφορετικά μοριακά σχήματα;
1. Ηλεκτρόνια και συγκόλληση σθένους:
* Αριθμός ηλεκτρονίων σθένους: Τα άτομα έχουν συγκεκριμένο αριθμό ηλεκτρονίων σθένους (ηλεκτρόνια στο εξώτατο κέλυφος) που χρησιμοποιούν για συγκόλληση. Ο αριθμός των ομολόγων που μπορεί να σχηματίσει ένα άτομο μπορεί να καθορίζει τη βασική του δομή.
* Τύποι ομολόγων: Οι ομοιοπολικοί δεσμοί, όπου τα άτομα μοιράζονται ηλεκτρόνια, μπορούν να είναι ενιαία, διπλά ή τριπλά ομόλογα. Κάθε τύπος δεσμού επηρεάζει τις γωνίες και τις αποστάσεις μεταξύ των ατόμων.
* υβριδοποίηση: Τα άτομα μπορούν να αναμίξουν τα ατομικά τροχιακά τους για να δημιουργήσουν νέα υβριδικά τροχιακά που είναι πιο κατάλληλα για συγκόλληση. Αυτή η διαδικασία αλλάζει το σχήμα του μορίου.
2. Απόσπαση μεταξύ ζευγών ηλεκτρονίων:
* Ζεύγη: Τα ηλεκτρόνια που δεν εμπλέκονται στη συγκόλληση (μοναχικά ζεύγη) συμβάλλουν επίσης στο σχήμα ενός μορίου. Τα ζεύγη Lone ασκούν μια ισχυρή απωθητική δύναμη στα ζεύγη συγκόλλησης, επηρεάζοντας τις γωνίες δεσμών.
* Απομάκρυνο ηλεκτρονίων-ηλεκτρονίων: Τα ζεύγη ηλεκτρονίων, είτε συνδέονται είτε μοναδικά ζεύγη, απωθούν μεταξύ τους και προσπαθούν να παραμείνουν όσο το δυνατόν πιο μακριά. Αυτή η απόρριψη καθορίζει το συνολικό σχήμα του μορίου.
3. Μοριακή γεωμετρία:
* Θεωρία VSEPR (Απομάκρυνση ζεύγους ηλεκτρονίων κελύφους σθένους): Αυτή η θεωρία εξηγεί τα σχήματα των μορίων που βασίζονται στη διάταξη των ζευγών ηλεκτρονίων γύρω από το κεντρικό άτομο. Το σχήμα ελαχιστοποιεί την απόρριψη μεταξύ ζευγών ηλεκτρονίων.
* υβριδοποίηση: Ο τύπος υβριδισμού του κεντρικού ατόμου επηρεάζει επίσης τη μοριακή γεωμετρία.
Παραδείγματα:
* νερό (h₂o): Το κεντρικό άτομο οξυγόνου έχει δύο μοναχικά ζεύγη και δύο ζεύγη συγκόλλησης, με αποτέλεσμα ένα λυγισμένο σχήμα.
* μεθάνιο (ch₄): Το κεντρικό άτομο άνθρακα έχει τέσσερα ζεύγη συγκόλλησης με άτομα υδρογόνου, με αποτέλεσμα τετραεδρικό σχήμα.
* διοξείδιο του άνθρακα (CO₂): Το κεντρικό άτομο άνθρακα έχει δύο διπλούς δεσμούς με άτομα οξυγόνου, με αποτέλεσμα ένα γραμμικό σχήμα.
Σημασία του μοριακού σχήματος:
Το μοριακό σχήμα είναι ζωτικής σημασίας επειδή καθορίζει ένα μόριο:
* Αντιδραστικότητα: Το σχήμα επηρεάζει τον τρόπο με τον οποίο αλληλεπιδρούν τα μόρια με άλλα μόρια, επηρεάζοντας τις χημικές τους αντιδράσεις.
* Ιδιότητες: Οι φυσικές ιδιότητες όπως το σημείο βρασμού, το σημείο τήξης και η διαλυτότητα επηρεάζονται από το σχήμα του μορίου.
* Βιολογική λειτουργία: Το σχήμα των μορίων διαδραματίζει κρίσιμο ρόλο στις βιολογικές διεργασίες, όπως η ενζυμική δραστικότητα και οι αλληλεπιδράσεις πρωτεΐνης-πρωτεΐνης.
Συμπερασματικά, τα μοναδικά σχήματα των μορίων είναι αποτέλεσμα της αλληλεπίδρασης μεταξύ του αριθμού των ηλεκτρονίων σθένους, των τύπων δεσμών, της απόρριψης μεταξύ των ζευγών ηλεκτρονίων και της προκύπτουσας μοριακής γεωμετρίας. Αυτά τα σχήματα είναι απαραίτητα για την κατανόηση της χημικής συμπεριφοράς, των φυσικών ιδιοτήτων και των βιολογικών λειτουργιών ενός μορίου.