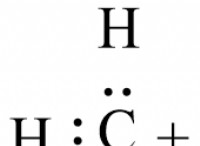Πώς σχηματίζεται ο ιονικός δεσμός σε μια ένωση;
τα βασικά
* Ιονικά ομόλογα σχηματίζονται μεταξύ ενός μετάλλου και ενός μη μέταλλου.
* μέταλλα τείνουν να χάσουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων (συνήθως ένα πλήρες εξωτερικό κέλυφος).
* Μη μέταλλα τείνουν να κερδίζουν ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων.
* Ηλεκτροστατική έλξη: Τα αντίθετα φορτία των ιόντων που προκύπτουν (μεταλλικό κατιόν και μη μέταλλο ανιόν) προσελκύουν ο ένας τον άλλον έντονα, σχηματίζοντας τον ιονικό δεσμό.
Η διαδικασία
1. Μεταφορά ηλεκτρονίων: Όταν ένα άτομο μετάλλου συναντά ένα μη μέταλλο άτομο, το άτομο μετάλλου χάνει εύκολα ένα ή περισσότερα ηλεκτρόνια, καθιστώντας θετικά φορτισμένο ιόν (κατιόν). Το μη μεταλλικό άτομο κερδίζει αυτά τα ηλεκτρόνια, καθιστώντας ένα αρνητικά φορτισμένο ιόν (ανιόν).
2. Σχηματισμός ιόντων: Ας πάρουμε ένα παράδειγμα:
* Το νάτριο (Na) έχει ένα ηλεκτρόνιο στο εξωτερικό του κέλυφος. Θέλει να χάσει αυτό το ηλεκτρόνιο για να γίνει σταθερό.
* Το χλώριο (CL) έχει επτά ηλεκτρόνια στο εξωτερικό του κέλυφος. Θέλει να κερδίσει ένα ηλεκτρόνιο για να γίνει σταθερό.
Όταν αντιδρούν το νάτριο και το χλώριο, το νάτριο χάνει το ηλεκτρόνιο του, καθιστώντας ένα ιόν νατρίου (Na+) και το χλώριο κερδίζει αυτό το ηλεκτρόνιο, καθιστώντας ένα χλωριούχο ιόν (cl-).
3. Ηλεκτροστατική έλξη: Το θετικά φορτισμένο ιόν νατρίου (Na+) και το αρνητικά φορτισμένο χλωριούχο ιόν (Cl-) προσελκύονται τώρα μεταξύ τους λόγω των αντίθετων φορτίων τους. Αυτή η ισχυρή ηλεκτροστατική έλξη είναι αυτό που συνιστά τον ιονικό δεσμό.
4. σχηματισμός κρυστάλλου: Τα προκύπτοντα ιόντα οργανώνονται σε μια τακτική, επαναλαμβανόμενη τρισδιάστατη δομή που ονομάζεται κρυσταλλικό πλέγμα. Αυτή η δομή πλέγματος βοηθά στη μεγιστοποίηση της ηλεκτροστατικής έλξης μεταξύ των ιόντων, δημιουργώντας μια σταθερή ένωση.
Παράδειγμα:Χλωριούχο νάτριο (NaCl)
Το χλωριούχο νάτριο (επιτραπέζιο αλάτι) είναι ένα κλασικό παράδειγμα ιοντικής ένωσης:
* νάτριο (na) , ένα μέταλλο, χάνει ένα ηλεκτρόνιο για να γίνει Na+.
* χλώριο (cl) , ένα μη μέταλλο, κερδίζει ένα ηλεκτρόνιο για να γίνει cl-.
* Τα αντίθετα φορτισμένα ιόντα, Na+ και Cl-, προσελκύουν ο ένας τον άλλον έντονα, σχηματίζοντας έναν ιοντικό δεσμό.
* Αυτά τα ιόντα οργανώνονται σε ένα κρυσταλλικό πλέγμα, δημιουργώντας τους γνωστούς λευκούς κρυστάλλους του τραπεζιού αλατιού.
Βασικά σημεία που πρέπει να θυμάστε:
* Οι ιοντικοί δεσμοί περιλαμβάνουν τη μεταφορά ηλεκτρονίων.
* Οι ιοντικές ενώσεις είναι συνήθως στερεές σε θερμοκρασία δωματίου.
* Έχουν υψηλά σημεία τήξης και βρασμού λόγω των ισχυρών ηλεκτροστατικών δυνάμεων που συγκρατούν τα ιόντα μαζί.
* Οι ιοντικές ενώσεις είναι συχνά διαλυτές στο νερό επειδή τα μόρια του νερού μπορούν να περιβάλλουν και να διαχωρίσουν τα ιόντα.