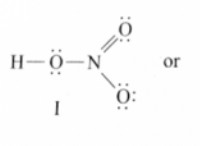
Τι είναι ο δεσμός υδρογόνου ειδική μορφή;
Εδώ είναι γιατί:
* αλληλεπιδράσεις διπόλης-διπόλης εμφανίζονται μεταξύ πολικών μορίων, όπου το ένα άκρο του μορίου έχει ένα μερικό θετικό φορτίο (δ+) και το άλλο άκρο έχει μερικό αρνητικό φορτίο (δ-). Αυτές οι αντίθετες χρεώσεις προσελκύουν ο ένας τον άλλον.
* δεσμούς υδρογόνου είναι ένας συγκεκριμένος τύπος αλληλεπίδρασης διπολικής-δίπολας όπου ένα άτομο υδρογόνου συνδέεται με ένα εξαιρετικά ηλεκτροαρνητικό άτομο (όπως το οξυγόνο, το άζωτο ή το φθόριο) προσελκύεται από το μοναδικό ζεύγος ηλεκτρονίων σε ένα άλλο εξαιρετικά ηλεκτροαρνητικό άτομο.
Η βασική διαφορά μεταξύ των τακτικών αλληλεπιδράσεων διπολικής-διπόλης και των δεσμών υδρογόνου είναι η αντοχή της έλξης. Οι δεσμοί υδρογόνου είναι πολύ ισχυρότεροι λόγω της υψηλής ηλεκτροαρνητικότητας των εμπλεκόμενων ατόμων και του μικρού μεγέθους του ατόμου υδρογόνου. Αυτό οδηγεί σε ένα πιο συγκεντρωμένο θετικό φορτίο στο άτομο υδρογόνου, οδηγώντας σε ισχυρότερη έλξη.