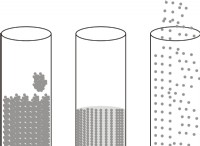
Τι συμβαίνει με τα ιόντα μιας συμπαγής ουσίας ιόντων όταν διαλύεται στο νερό;
1. Έλξη και διάσταση
* Το νερό είναι πολικό: Τα μόρια του νερού έχουν ελαφρώς θετικό άκρο (κοντά στα άτομα υδρογόνου) και ένα ελαφρώς αρνητικό άκρο (κοντά στο άτομο οξυγόνου).
* Ιωνικές ενώσεις έχουν χρεώσει ιόντα: Οι ιοντικές ενώσεις συγκρατούνται από ισχυρά ηλεκτροστατικά αξιοθέατα μεταξύ θετικά φορτισμένων κατιόντων και αρνητικά φορτισμένων ανιόντων.
* Μόρια νερού περιβάλλουν ιόντα: Όταν μια ιοντική ένωση τοποθετείται σε νερό, τα πολικά μόρια νερού προσελκύονται από τα φορτισμένα ιόντα. Τα θετικά άκρα των μορίων του νερού περιβάλλουν τα ανιόντα και τα αρνητικά άκρα των μορίων νερού περιβάλλουν τα κατιόντα.
2. Σπάζοντας τον ιονικό δεσμό
* Ενυδάτωση: Η ισχυρή έλξη μεταξύ των μορίων του νερού και των ιόντων ξεπερνά την ηλεκτροστατική έλξη που συγκρατεί τα ιόντα στο στερεό πλέγμα.
* Διάσπαση: Οι ιοντικοί δεσμοί σπάζουν και τα μεμονωμένα ιόντα περιβάλλονται από μόρια νερού. Αυτή η διαδικασία ονομάζεται ενυδάτωση.
3. Ιόντα σε διάλυμα
* Ελεύθερα κινούμενα ιόντα: Μόλις διαχωριστούν, τα ιόντα είναι ελεύθερα να κινούνται ανεξάρτητα στη λύση.
* ηλεκτρολύτης: Το διάλυμα που περιέχει τα διαλυμένα ιόντα γίνεται ηλεκτρολύτης, που σημαίνει ότι μπορεί να διεξάγει ηλεκτρική ενέργεια.
Παράδειγμα:
Εξετάστε το τραπέζι αλάτι (NaCl). Όταν διαλύεται στο νερό, συμβαίνει τα ακόλουθα:
* NaCl (s) → Na + (aq) + cl- (aq)
Το στερεό χλωριούχο νάτριο (NaCl) διαχωρίζεται σε ενυδατωμένα ιόντα νατρίου (Na+) και ενυδατωμένα ιόντα χλωριούχου (Cl-). Το "(aq)" υποδεικνύει ότι τα ιόντα περιβάλλονται τώρα από μόρια νερού στο διάλυμα.
Βασικά σημεία:
* Η διαδικασία διάλυσης μιας ιοντικής ένωσης στο νερό είναι μια φυσική αλλαγή . Η χημική σύνθεση των ίδιων των ιόντων δεν αλλάζει.
* Η ικανότητα μιας ιοντικής ένωσης να διαλύεται στο νερό εξαρτάται από τη δύναμη των ιοντικών δεσμών και την έλξη μεταξύ των ιόντων και των μορίων του νερού.
* Η προκύπτουσα λύση είναι ένα ομοιογενές μίγμα όπου τα διαλυμένα ιόντα κατανέμονται ομοιόμορφα σε όλο το νερό.