Mole Ratio – Ορισμός και Παραδείγματα
Η μοριακή αναλογία περιγράφει τις σταθερές αναλογίες μεταξύ των αντιδρώντων και των προϊόντων σε μια χημική αντίδραση. Είναι σημαντικό στη στοιχειομετρία, ιδιαίτερα όταν χρησιμοποιείται ως παράγοντας μετατροπής στις μετατροπές mole σε gram. Ακολουθεί ο ορισμός της αναλογίας mole, με παραδείγματα που δείχνουν πώς να βρείτε την αναλογία και να τη χρησιμοποιήσετε.
Ορισμός αναλογίας γραμμομορίων
Η μοριακή αναλογία είναι η αναλογία μεταξύ οποιωνδήποτε δύο ουσιών σε μια χημική αντίδραση. Είναι η αναλογία μεταξύ δύο συντελεστών σε μια ισορροπημένη χημική εξίσωση. Η μοριακή αναλογία είναι επίσης γνωστή ως μοριακή αναλογία ή αναλογία mole-to-mole.
Εύρεση της αναλογίας γραμμομορίων σε μια ισορροπημένη εξίσωση
Βρείτε τη μοριακή αναλογία μεταξύ οποιωνδήποτε δύο συστατικών μιας χημικής αντίδρασης χρησιμοποιώντας τους συντελεστές των χημικών τύπων. Οι συντελεστές είναι οι αριθμοί μπροστά από τον τύπο.
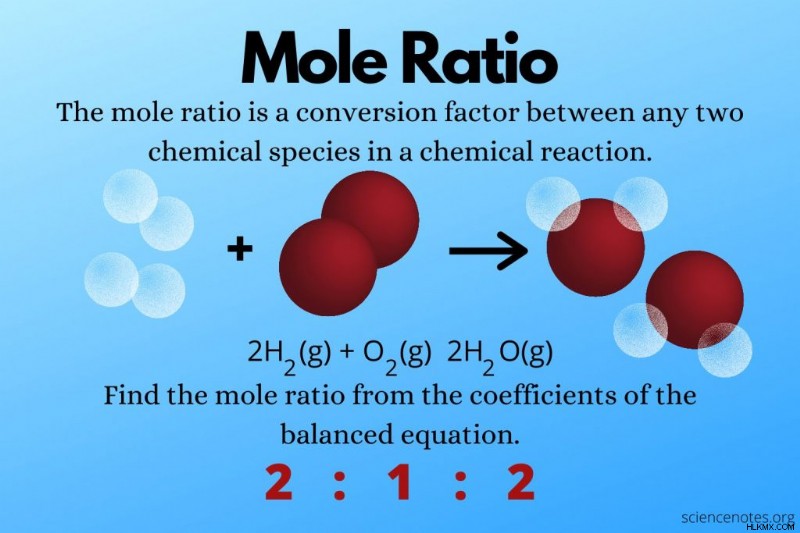
Για παράδειγμα, στην εξίσωση για την αντίδραση μεταξύ υδρογόνου και οξυγόνου για τη δημιουργία νερού:
2 H2 (ζ) + O2 (ζ) → 2 H2 O(g)
Ο συντελεστής για το υδρογόνο είναι 2. Για το οξυγόνο, δεν υπάρχει συντελεστής, που σημαίνει 1. Ο συντελεστής για το νερό είναι 2.
Η μοριακή αναλογία μεταξύ υδρογόνου και οξυγόνου είναι 2:1. Η μοριακή αναλογία μεταξύ οξυγόνου και νερού είναι 1:2. Η μοριακή αναλογία μεταξύ υδρογόνου και νερού είναι 2:2, αλλά μπορείτε να την μειώσετε σε 1:1.
Εύρεση της αναλογίας γραμμομορίων σε μια μη ισορροπημένη εξίσωση
Για να γράψετε μια μοριακή αναλογία, χρειάζεστε μια ισορροπημένη εξίσωση. Εάν σας δοθεί μια μη ισορροπημένη εξίσωση, η εξισορρόπηση είναι το πρώτο σας βήμα.
Για παράδειγμα, εξετάστε την αντίδραση που μετατρέπει το όζον σε οξυγόνο:
O3 → O2
Αυτή η χημική εξίσωση δεν είναι ισορροπημένη. Πως ξέρεις? Μια ισορροπημένη εξίσωση έχει τον ίδιο αριθμό και τον ίδιο τύπο ατόμων και στις δύο πλευρές του βέλους της αντίδρασης. Στη δεδομένη εξίσωση, υπάρχουν 3 άτομα οξυγόνου στην αριστερή πλευρά του βέλους και δύο άτομα οξυγόνου στη δεξιά πλευρά του βέλους. Ισορροπήστε την εξίσωση προσθέτοντας συντελεστές μπροστά από τα αντιδρώντα και τα προϊόντα μέχρι ο αριθμός των ατόμων να είναι ίδιος και στις δύο πλευρές.
Η ισορροπημένη εξίσωση είναι:
2O3 → 3O2
Τώρα, λάβετε τη μοριακή αναλογία χρησιμοποιώντας τους συντελεστές. Η αναλογία είναι 2 μόρια όζοντος προς 3 μόρια οξυγόνου ή 2:3.
Παράδειγμα προβλήματος με τη χρήση της αναλογίας γραμμομορίων
Μια αναλογία είναι απλώς ένας τρόπος να δείξεις μια σχέση μεταξύ δύο πραγμάτων. Στη χημεία, η σημασία της είναι ότι μπορείτε να χρησιμοποιήσετε την αναλογία για να λύσετε προβλήματα στοιχειομετρίας.
Για παράδειγμα, ας υποθέσουμε ότι σας ζητείται να μάθετε πόσα mole οξυγόνου παίρνετε αντιδρώντας 4 moles όζοντος. Ένας τρόπος για να λυθεί αυτό είναι να ρυθμίσετε την αναλογία σαν ισοδύναμα κλάσματα:
4 moles όζοντος / x moles οξυγόνου =2 moles όζοντος / 3 moles οξυγόνου
Επίλυση για "x":
x moles οξυγόνο =(4 moles όζοντος)*(3 moles οξυγόνο)/2 moles όζον
x moles οξυγόνο =6
Σημειώστε ότι οι «μονάδες» για τα mole του όζοντος ακυρώνονται, αφήνοντας mole οξυγόνου. Ελέγξτε ξανά τη δουλειά σας! Το πιο συνηθισμένο λάθος που κάνουν οι μαθητές σε αυτόν τον υπολογισμό είναι να ρυθμίζουν τα κλάσματα έτσι ώστε οι μονάδες να μην ακυρώνονται.
Συνήθως, θα λάβετε μια τιμή σε γραμμάρια και θα σας ζητηθεί μια απάντηση σε γραμμάρια. Η μοριακή αναλογία δεν λειτουργεί με μονάδες μάζας, όπως τα γραμμάρια. Έτσι, μπορείτε να κάνετε την άλγεβρα και τη μετατροπή gram-to-mole και mole-to-gram. Ο συνδυασμός όλων αυτών των δεξιοτήτων απαιτεί εξάσκηση.
Για παράδειγμα, βρείτε πόσα γραμμάρια οξυγόνου λαμβάνετε από την αντίδραση 0,2 γραμμαρίων όζοντος.
- Πρώτον, λάβετε μια ισορροπημένη εξίσωση για την αντίδραση που παράγει το οξυγόνο από το όζον. Από αυτό, γράψτε τη μοριακή αναλογία.
- Στη συνέχεια, βρείτε τον αριθμό των moles σε 0,2 g όζοντος. Για να κάνετε τη μετατροπή mole σε γραμμάριο, αναζητήστε την ατομική μάζα του οξυγόνου στον περιοδικό πίνακα. Υπάρχουν 16,00 γραμμάρια οξυγόνου ανά mole οξυγόνου.
- Επίλυση του προβλήματος μετατροπής:
x moles =0,2 γραμμάρια * (1 mole/16,00 g) =0,0125 moles - Χρησιμοποιήστε τη μοριακή αναλογία για να βρείτε πόσα γραμμομόρια οξυγόνου σχηματίζονται από 0,125 γραμμομόρια όζοντος.
moles οξυγόνου =0,125 moles όζοντος * (3 moles οξυγόνου/2 moles όζοντος)
moles οξυγόνου =0,01875 moles αέριο οξυγόνο - Τώρα, μετατρέψτε τα mol αερίου οξυγόνου σε γραμμάρια αερίου οξυγόνου για να λάβετε την τελική απάντηση:
γραμμάρια αερίου οξυγόνου =0,01875 moles * 16,00 γραμμάρια/mole
γραμμάρια αερίου οξυγόνου =0,3 γραμμάρια
Σε αυτήν την περίπτωση, θα μπορούσατε πραγματικά να έχετε σώσει στον εαυτό σας κάποια μαθηματικά επειδή μόνο ένας τύπος ατόμου (οξυγόνο) εμφανίστηκε και στις δύο πλευρές της χημικής εξίσωσης. Ωστόσο, είναι καλή πρακτική να ακολουθήσετε όλα τα βήματα. Επίσης, θυμηθείτε να αναφέρετε την απάντησή σας χρησιμοποιώντας τον σωστό αριθμό σημαντικών αριθμών.
Τέλος, αναγνωρίστε ότι μπορεί να σας δοθεί οποιοδήποτε αντιδραστήριο ή προϊόν και μπορείτε να χρησιμοποιήσετε την ίδια τεχνική για να βρείτε την ποσότητα οποιουδήποτε άλλου αντιδραστηρίου ή προϊόντος. Μερικές φορές θα έχετε δύο ποσότητες και θα χρησιμοποιήσετε τη μοριακή αναλογία για να βρείτε το περιοριστικό αντιδραστήριο.
Η αναλογία γραμμομορίων ως μονάδα συγκέντρωσης
Στη στοιχειομετρία, η μοριακή αναλογία είναι η αναλογία μεταξύ γραμμομορίων ειδών σε μια ισορροπημένη χημική εξίσωση, αλλά η μοριακή αναλογία είναι επίσης μονάδα συγκέντρωσης σε ορισμένους κλάδους. Για παράδειγμα, στην ατμοσφαιρική χημεία, ο γραμμομοριακός λόγος είναι η τιμή που προκύπτει από τη διαίρεση των γραμμομορίων του συστατικού ενδιαφέροντος με τον συνολικό αριθμό γραμμομορίων μιας ουσίας:
ri =ni / ntot
Εδώ, ri είναι ο γραμμομοριακός λόγος του i , ni είναι ο αριθμός των moles του i , και ntot είναι ο συνολικός αριθμός των σπίλων. Για να αποφευχθεί η σύγχυση, η μονάδα συγκέντρωσης μπορεί να είναι γνωστή ως μοριακό κλάσμα και όχι ως μοριακός λόγος.
Αναφορά
- IUPAC (1997) Σύνοψη Χημικής Ορολογίας (το «Χρυσό Βιβλίο»). (2η έκδ.). Επιστημονικές Εκδόσεις Blackwell. ISBN 0-9678550-9-8.




