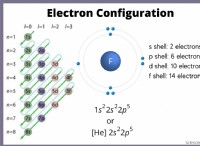
Γιατί το F γενικά σχηματίζει ομοιοπολικούς δεσμούς με μεγάλη πολικότητα;
1. Υψηλή ηλεκτροαρνητικότητα: Το φθόριο έχει την υψηλότερη ηλεκτροαρνητικότητα όλων των στοιχείων. Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια σε έναν δεσμό. Όσο υψηλότερη είναι η ηλεκτροαρνητικότητα, τόσο ισχυρότερη είναι η έλξη στα κοινόχρηστα ηλεκτρόνια. Αυτό σημαίνει ότι η φθορίνη τραβά έντονα τα ηλεκτρόνια συγκόλλησης προς τον εαυτό του σε έναν ομοιοπολικό δεσμό.
2. Μικρό μέγεθος ατομικού: Το φθόριο είναι ένα μικρό άτομο με συμπαγές σύννεφο ηλεκτρονίων. Αυτό επιτρέπει στον πυρήνα του ατόμου φθορίου να ασκεί ισχυρότερη έλξη στα ηλεκτρόνια συγκόλλησης. Όσο πιο κοντά τα ηλεκτρόνια είναι στον πυρήνα, τόσο ισχυρότερη είναι η έλξη.
3. Ενέργεια υψηλής ιονισμού: Το φθόριο έχει πολύ υψηλή ενέργεια ιονισμού, που σημαίνει ότι απαιτεί πολλή ενέργεια για την απομάκρυνση ενός ηλεκτρονίου. Αυτό συμβάλλει στην τάση του να προσελκύει ηλεκτρόνια και όχι να τα χάσει.
Συνέπειες της υψηλής πολικότητας:
Η υψηλή πολικότητα των ομοιοπολικών δεσμών που περιέχει F οδηγεί σε:
* Σημαντικά μερική χρέωση: Τα ηλεκτρόνια του δεσμού περνούν περισσότερο χρόνο γύρω από το άτομο φθορίου, δημιουργώντας ένα μερικό αρνητικό φορτίο (δ-) στο φθόριο και ένα μερικό θετικό φορτίο (δ+) από το άλλο άτομο του δεσμού.
* Ισχυρές διπολικές στιγμές: Ο διαχωρισμός των φορτίων δημιουργεί μια διπολική στιγμή, ένα μέτρο της πολικότητας ενός μορίου. Τα μόρια με εξαιρετικά πολικούς δεσμούς έχουν μεγάλες διπολικές στιγμές.
* Ισχυρές διαμοριακές δυνάμεις: Οι μερικές φορτίες σε πολικά μόρια οδηγούν σε ισχυρές διαμοριακές δυνάμεις όπως οι αλληλεπιδράσεις διπολικής-δίπολης και η δέσμευση υδρογόνου. Αυτές οι δυνάμεις συμβάλλουν σε υψηλότερα σημεία βρασμού και σημεία τήξης για ουσίες με εξαιρετικά πολικούς δεσμούς.
Παράδειγμα:
Στο μόριο φθοριούχου υδρογόνου (HF), ο ομοιοπολικός δεσμός μεταξύ υδρογόνου και φθορίου είναι εξαιρετικά πολικός. Το άτομο φθορίου προσελκύει τα κοινόχρηστα ηλεκτρόνια, δημιουργώντας ένα μερικό αρνητικό φορτίο στο φθόριο και ένα μερικό θετικό φορτίο στο υδρογόνο. Αυτή η πολικότητα οδηγεί σε μια ισχυρή διπολική στιγμή και ισχυρή δέσμευση υδρογόνου μεταξύ των μορίων HF.
Συμπερασματικά, η υψηλή ηλεκτροαρνητικότητα, το μικρό μέγεθος και η υψηλή ενέργεια ιονισμού του φθορίου καθιστούν εξαιρετικά αποτελεσματική στην προσέλκυση ηλεκτρονίων σε ομοιοπολικούς δεσμούς, οδηγώντας σε σημαντική πολικότητα. Αυτή η πολικότητα έχει σημαντικές επιπτώσεις στις ιδιότητες των μορίων που περιέχουν φθόριο.