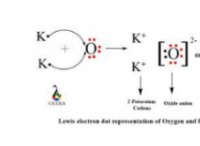
Ποια είναι η διαφορά μεταξύ ενός αλογόνου και ενός αλκαλίου μετάλλου;
αλογόνα:
* Τοποθεσία στον περιοδικό πίνακα: Ομάδα 17 (VIIA)
* Διαμόρφωση ηλεκτρονίων: Έχετε 7 ηλεκτρόνια σθένους (ηλεκτρόνια στο εξώτατο κέλυφος)
* Χημική αντιδραστικότητα: Εξαιρετικά αντιδραστικά μη μέταλλα. Τείνουν να κερδίζουν Ένα ηλεκτρόνιο για την επίτευξη ενός σταθερού οκτάτη (8 ηλεκτρόνια σθένους) και σχηματίζουν αρνητικά φορτισμένα ιόντα (ανιόντες).
* Φυσικές ιδιότητες:
* Υπάρχουν ως διατομικά μόρια (F₂, CL₂, Br₂, i₂, At₂) σε θερμοκρασία δωματίου.
* Ποικίλλουν σε φυσική κατάσταση από αέρια (φθόριο και χλώριο) σε υγρά (βρωμίνη) σε στερεά (ιώδιο και αστάνη).
* Παραδείγματα: Φθόριο (F), Χλώριο (CL), Βρωμίνη (BR), Ιώδιο (Ι), Αστάτι (AT)
Αλκαλικά μέταλλα:
* Τοποθεσία στον περιοδικό πίνακα: Ομάδα 1 (ΙΑ)
* Διαμόρφωση ηλεκτρονίων: Έχετε 1 ηλεκτρόνιο σθένους.
* Χημική αντιδραστικότητα: Εξαιρετικά αντιδραστικά μέταλλα. Τείνουν να χάσουν το ηλεκτρόνιο ενός σθένους για να επιτύχει ένα σταθερό οκτάτο και να σχηματίσει θετικά φορτισμένα ιόντα (κατιόντα).
* Φυσικές ιδιότητες:
* Μαλακά, ασημένια λευκά μέταλλα
* Εξαιρετικά αντιδραστική με νερό και αέρα, έτσι ώστε να αποθηκεύονται κάτω από λάδι.
* Παραδείγματα: Το λίθιο (Li), το νάτριο (Na), το κάλιο (k), το ρουμπίντιο (RB), το καίσο (CS), το francium (FR)
Βασικές διαφορές:
* Ηλεκτροργατιστικότητα: Τα αλογόνα είναι εξαιρετικά ηλεκτροαρνητικά, που σημαίνει ότι προσελκύουν ηλεκτρόνια έντονα, ενώ τα αλκαλικά μέταλλα είναι εξαιρετικά ηλεκτροθετικά, πράγμα που σημαίνει ότι εγκαταλείπουν εύκολα τα ηλεκτρόνια.
* Αντιδραστικότητα: Και οι δύο είναι εξαιρετικά αντιδραστικές, αλλά τα αλκαλικά μέταλλα αντιδρούν κυρίως με την απώλεια ηλεκτρονίων, ενώ τα αλογόνα αντιδρούν κυρίως με την απόκτηση ηλεκτρονίων.
* Φυσική κατάσταση: Τα αλογόνα μπορούν να βρεθούν και στις τρεις καταστάσεις ύλης σε θερμοκρασία δωματίου, ενώ τα αλκαλικά μέταλλα είναι όλα στερεά μέταλλα.
* σχηματισμός ιόντων: Τα αλογόνα σχηματίζουν ανιόντα (-1 φορτία), ενώ τα αλκαλικά μέταλλα σχηματίζουν κατιόντα (+1 φορτίο).
Συνοπτικά: Τα αλογόνα είναι μη μέταλλα που θέλουν ηλεκτρονικά που θέλουν να κερδίσουν ένα ηλεκτρόνιο, ενώ τα αλκάλια μέταλλα είναι μέταλλα που δίνουν ηλεκτρονίων που θέλουν να χάσουν ένα ηλεκτρόνιο. Οι αντίθετες ιδιότητές τους τους καθιστούν πολύ διαφορετικά στοιχεία με διαφορετικές εφαρμογές.