Πώς ο Niels Bohr ξεπέρασε το πρόβλημα με το μοντέλο Rutherford του ατόμου;
Μοντέλο του Rutherford:
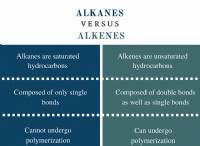
* Πλεονεκτήματα: Εξήγησε την ύπαρξη ενός πυκνού, θετικά φορτισμένου πυρήνα και τη διάταξη των ηλεκτρονίων γύρω από αυτό.
* Αδυναμία:
* Δεν μπόρεσε να εξηγήσει τη σταθερότητα των ατόμων: Τα ηλεκτρόνια που περιστρέφονται γύρω από έναν πυρήνα, όπως οι πλανήτες γύρω από τον ήλιο, θα πρέπει να χάνουν συνεχώς ενέργεια και σπείρα στον πυρήνα, προκαλώντας την κατάρρευση των ατόμων.
* Δεν μπορούσε να εξηγήσει τη διακριτή φύση του φωτός που εκπέμπεται από τα άτομα: Τα άτομα εκπέμπουν φως μόνο σε συγκεκριμένα μήκη κύματος, όχι ένα συνεχές φάσμα όπως αναμένεται από τα ηλεκτρόνια που σπειροειδή.
Μοντέλο Bohr:
* Κτίριο στο μοντέλο του Rutherford: Ο Bohr διατήρησε την ιδέα ενός κεντρικού πυρήνα με τα ηλεκτρόνια που τον περιστρέφονται.
* Τροποποιήσεις κλειδιών:
* Κοσβατικά επίπεδα ενέργειας: Τα ηλεκτρόνια μπορούν να καταλαμβάνουν μόνο συγκεκριμένες τροχιές με σταθερές ενέργειες, που ονομάζονται επίπεδα ενέργειας.
* Χωρίς απώλεια ενέργειας κατά τη διάρκεια της τροχιάς: Τα ηλεκτρόνια σε αυτές τις σταθερές τροχιές δεν χάνουν ενέργεια, εμποδίζοντας τους να στρέφονται στον πυρήνα.
* εκπομπή και απορρόφηση ενέργειας: Τα ηλεκτρόνια μπορούν να μεταβούν μεταξύ των επιπέδων ενέργειας απορροφώντας ή εκπέμποντας φωτόνια συγκεκριμένων ενεργειών, που αντιστοιχούν στα παρατηρούμενα διακριτά μήκη κύματος του φωτός.
Το μοντέλο του Bohr εξήγησε με επιτυχία:
* Η σταθερότητα των ατόμων: Τα σταθερά επίπεδα ενέργειας εμπόδισαν την κατάρρευση των ηλεκτρονίων.
* Η διακριτή φύση του εκπεμπόμενου φωτός: Οι ειδικές ενεργειακές διαφορές μεταξύ των επιπέδων εξήγησαν τα ξεχωριστά μήκη κύματος του φωτός που εκπέμπονται από τα άτομα.
Ωστόσο, το μοντέλο του Bohr είχε ακόμα περιορισμούς:
* Δεν μπόρεσε να εξηγήσει τα φάσματα ατόμων με περισσότερα από ένα ηλεκτρόνια: Το μοντέλο ήταν μόνο επιτυχημένο για το υδρογόνο, το απλούστερο άτομο.
* Ήταν ένα ημι-κλασσικό μοντέλο: Χρησιμοποίησε την κλασσική φυσική για να εξηγήσει την τροχιά του ηλεκτρονίου ενώ ενσωματώνει κβαντικές ιδέες για τα επίπεδα ενέργειας.
Περαιτέρω εξελίξεις:
* Κβαντική μηχανική: Η ανάπτυξη της κβαντικής μηχανικής οδήγησε σε μια ακριβέστερη περιγραφή της ατομικής δομής, αντικαθιστώντας το μοντέλο του Bohr με ένα πιο περίπλοκο αλλά πιο ρεαλιστικό μοντέλο.
Συμπερασματικά, ο Bohr δεν ξεπέρασε εξ ολοκλήρου το μοντέλο του Rutherford, αλλά το βελτίωσε σημαντικά εισάγοντας την έννοια των επιπέδων κβαντισμένων ενεργειακών επιπέδων, εξηγώντας έτσι τη σταθερότητα των ατόμων και τη διακριτή φύση της εκπομπής φωτός. Ωστόσο, το μοντέλο του ήταν περιορισμένο και τελικά αντικαταστάθηκε από την πιο προηγμένη κβαντική μηχανική περιγραφή του ατόμου.