Περιγράψτε τον κανόνα οκτάδων όσον αφορά τις διαμορφώσεις ευγενών αερίων και την πιθανή ενέργεια;
Ο κανόνας οκτάδων:Μια αναζήτηση για σταθερότητα
Ο κανόνας οκτάδων είναι μια κατευθυντήρια αρχή στη χημεία που μας βοηθά να κατανοήσουμε τη συμπεριφορά συγκόλλησης των ατόμων. Δηλώνει ότι τα άτομα τείνουν να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση ηλεκτρονίων που μοιάζουν με εκείνη του πλησιέστερου ευγενή αέριο.
Ας σπάσουμε αυτήν την ιδέα χρησιμοποιώντας διαμορφώσεις ευγενών αερίων και πιθανή ενέργεια:
1. Ευγενικές διαμορφώσεις αερίου:
* Τα ευγενή αέρια (He, NE, AR, KR, XE, RN) είναι τα πιο σταθερά στοιχεία στον περιοδικό πίνακα.
* Το εξωτερικό κέλυφος ηλεκτρονίων (κέλυφος σθένους) είναι πλήρως γεμάτο, δίνοντάς τους μια πολύ χαμηλή δυναμική ενέργεια.
* Αυτή η διαμόρφωση "πλήρους κελύφους" είναι ο λόγος για τον οποίο τα ευγενή αέρια είναι μη δραστικά και σπάνια σχηματίζουν χημικούς δεσμούς.
2. Ο κανόνας οκτάδων και η πιθανή ενέργεια:
* Τα περισσότερα άτομα έχουν ελλιπή κελύφη σθένους, καθιστώντας τα ασταθή και αντιδραστικά.
* Ο κανόνας οκτάδων υποδηλώνει ότι τα άτομα θα προσπαθήσουν να επιτύχουν μια σταθερή κατάσταση χαμηλής ενέργειας με την επίτευξη του ίδιου αριθμού ηλεκτρονίων στο κέλυφος σθένους τους ως το πλησιέστερο ευγενές αέριο.
* Αυτό σημαίνει συνήθως να έχουν οκτώ ηλεκτρόνια στο κέλυφος σθένους τους (εξ ου και το όνομα "Octet").
* Οι εξαιρέσεις είναι υδρογόνο και ήλιο, τα οποία στοχεύουν σε ένα ντουέτο (δύο ηλεκτρόνια) να μοιάζουν με τη διαμόρφωση του ήλιου.
3. Πώς τα άτομα επιτυγχάνουν την οκτάδα:
* Κερδίζοντας ηλεκτρόνια: Τα μη μέταλλα τείνουν να κερδίζουν ηλεκτρόνια για να επιτύχουν ένα πλήρες κέλυφος σθένους. Για παράδειγμα, το χλώριο (7 ηλεκτρόνια σθένους) μπορεί να κερδίσει ένα ηλεκτρόνιο για να γίνει ένα χλωριούχο ιόν (cl-) με 8 ηλεκτρόνια, που μοιάζουν με τη σταθερή διαμόρφωση αργού.
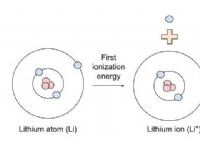
* απώλεια ηλεκτρόνων: Τα μέταλλα τείνουν να χάσουν ηλεκτρόνια για να επιτύχουν ένα πλήρες κέλυφος σθένους στο προηγούμενο επίπεδο ενέργειας. Για παράδειγμα, το νάτριο (1 ηλεκτρόνιο σθένους) μπορεί να χάσει ένα ηλεκτρόνιο για να γίνει ένα ιόν νατρίου (Na+) με 8 ηλεκτρόνια στο δεύτερο κέλυφος, που μοιάζει με τη σταθερή διαμόρφωση νέον.
* Κοινή χρήση ηλεκτρόνων: Τα άτομα μπορούν επίσης να μοιράζονται ηλεκτρόνια με άλλα άτομα μέσω ομοιοπολικών δεσμών. Αυτό τους επιτρέπει να "δανείζονται" ηλεκτρόνια και να επιτύχουν αποτελεσματικά ένα πλήρες κέλυφος σθένους χωρίς να κερδίζουν ή να χάνουν ηλεκτρόνια μόνιμα.
4. Πιθανές ενεργειακές επιπτώσεις:
* Η επίτευξη σταθερής διαμόρφωσης ηλεκτρονίων μέσω του κανόνα οκτάδων μειώνει την πιθανή ενέργεια ενός ατόμου, καθιστώντας την πιο σταθερή.
* Αυτή η μείωση της ενέργειας οδηγεί το σχηματισμό χημικών δεσμών, καθώς τα άτομα προσπαθούν να φτάσουν σε χαμηλότερη κατάσταση ενέργειας.
5. Εξαιρέσεις από τον κανόνα οκτώ:
* Ορισμένα στοιχεία μπορούν να υπάρχουν με λιγότερα ή περισσότερα από οκτώ ηλεκτρόνια στο κέλυφος σθένους τους, ιδιαίτερα στην περίπτωση μεταβατικών μετάλλων και στοιχείων στην τρίτη περίοδο και μετά.
* Αυτές οι εξαιρέσεις εξηγούνται από παράγοντες όπως οι τροχιακές ενέργειες και η διαθεσιμότητα D-orbitals για τη συγκόλληση.
Συνοπτικά:
Ο κανόνας οκτάδων είναι μια χρήσιμη κατευθυντήρια γραμμή για την κατανόηση της σύνδεσης και της αντιδραστικότητας. Εξηγεί γιατί τα άτομα σχηματίζουν ομόλογα και πώς επιτυγχάνουν σταθερότητα μιμώντας τη διαμόρφωση ηλεκτρονίων του πλησιέστερου ευγενή αέριο. Με την επίτευξη αυτής της σταθερής διαμόρφωσης χαμηλής ενέργειας, τα άτομα μειώνουν την πιθανή ενέργεια τους και γίνονται πιο χημικά σταθερά. Ωστόσο, είναι σημαντικό να θυμόμαστε ότι υπάρχουν εξαιρέσεις σε αυτόν τον κανόνα και οι πιο περίπλοκες παράγοντες μπορούν να επηρεάσουν τη συγκόλληση σε ορισμένες περιπτώσεις.