Ενέργεια Ιονισμού
Τι είναι η Ενέργεια Ιονισμού;
Ενέργεια ιονισμού , που ονομάζεται επίσηςδυναμικό ιονισμού , είναι μια ιδιότητα που έχουν όλα τα στοιχεία του περιοδικού πίνακα. Ποιος είναι λοιπόν ο ορισμός της ενέργειας ιονισμού; Είναι η ποσότητα ενέργειας που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα ουδέτερο άτομο, το οποίο σχηματίζει ένα ιόν. Συνήθως μετριέται σε kJ/mol και η μέτρηση βασίζεται σε ένα απομονωμένο άτομο στην αέρια φάση του. Ας μάθουμε πώς να την υπολογίσουμε, τι σημαίνει πρώτη και δεύτερη ενέργεια ιονισμού και πώς τείνει στον περιοδικό πίνακα.
Η ενέργεια ιοντισμού μπορεί να φανεί με την εξίσωση:
X + ενέργεια πρώτης ιοντισμού → X + e
Πού
- Το X είναι ουδέτερο άτομο
- Το X είναι ένα ιόν του ατόμου Χ με ένα μόνο θετικό φορτίο
- e είναι ένα ηλεκτρόνιο με ένα μόνο αρνητικό φορτίο
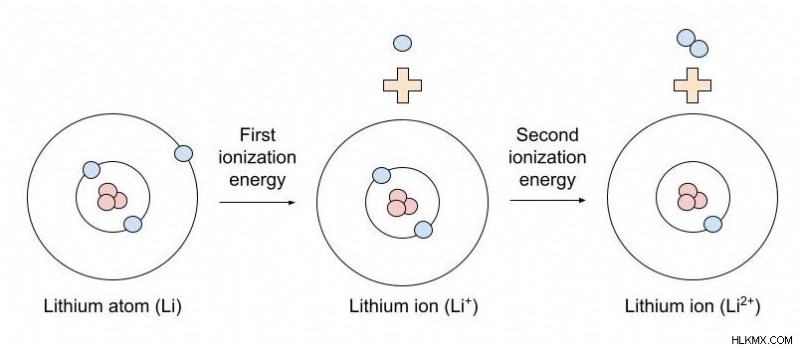
Τι εννοείται με τον όρο "πρώτη" ενέργεια ιονισμού;
Στην εξίσωση, η «πρώτη ενέργεια ιοντισμού» αναφέρεται στην ενέργεια ιοντισμού που απαιτείται για την αφαίρεση του πρώτου ηλεκτρονίου ενός ουδέτερου ατόμου, δίνοντας ένα ιόν με ένα μόνο θετικό φορτίο. Δεύτερη ενέργεια ιοντισμού είναι η ποσότητα ενέργειας που απαιτείται για να αφαιρεθεί ένα δεύτερο ηλεκτρόνιο από ένα ιόν 1+ (που σημαίνει ένα ιόν με ένα μόνο θετικό φορτίο), δίνοντας ένα ιόν με φορτίο 2+.
Τι είναι ένα ιόν;
Ένα ιόν είναι ένα θετικά ή αρνητικά φορτισμένο άτομο — παίρνει το φορτίο έχοντας έναν αριθμό ηλεκτρονίων άνισο με αυτόν των πρωτονίων του. Για παράδειγμα, το ιόν νατρίου, που γράφεται επίσης ως Na, έχει 11 πρωτόνια και 10 ηλεκτρόνια. Υπάρχει ένα πρωτόνιο περισσότερο από τα ηλεκτρόνια, με αποτέλεσμα το ιόν να είναι θετικά φορτισμένο. Ο αριθμός των πρωτονίων για οποιοδήποτε άτομο ή ιόν είναι πάντα σταθερός (ο αριθμός των πρωτονίων καθορίζει τον ατομικό αριθμό).
Πώς να υπολογίσετε την ενέργεια ιονισμού
Δυνατότητα ιοντισμού για το υδρογόνο μπορεί να υπολογιστεί χρησιμοποιώντας την ακόλουθη εξίσωση:
E =hcR H (1/n), όπου
- E είναι η ενέργεια του ηλεκτρονίου (ή η ποσότητα ενέργειας που απαιτείται για την απομάκρυνση του ηλεκτρονίου, ενέργεια ιονισμού)
- h είναι η σταθερά του Planck =6,626 * 10 Js (joules*second)
- γ είναι η ταχύτητα του φωτός =3,00 * 10 m/s (μέτρα/δευτερόλεπτο)
- R H είναι σταθερά Rydberg =1,097 * 10 m (1/μέτρο)
- n είναι ο κύριος κβαντικός αριθμός (ή ενεργειακό επίπεδο) του ηλεκτρονίου
Αφού συνδέσουμε τις τιμές των σταθερών, η εξίσωση γίνεται:
E =(2,18 * 10 J) (1/n)
Από εδώ, μπορείτε να συνδέσετε την τιμή του ενεργειακού επιπέδου του ηλεκτρονίου για να βρείτε την ποσότητα ενέργειας που απαιτείται για την αφαίρεσή του.
Τάση ενέργειας ιονισμού στον περιοδικό πίνακα

Για την τάση της ενέργειας ιονισμού στον περιοδικό πίνακα, θα υποθέσουμε ότι αναφερόμαστε πάντα στην πρώτη ενέργεια ιοντισμού των στοιχείων. Γενικά, (πρώτα) οι ενέργειες ιονισμού αυξάνονται προς την επάνω δεξιά γωνία του περιοδικού πίνακα, με το ήλιο να έχει την υψηλότερη ενέργεια ιοντισμού. Πριν αναλύσουμε την τάση στην περίοδο της και στις τάσεις της ομάδας, ας μιλήσουμε για έναν σημαντικό παράγοντα που συμβάλλει σε αυτήν την τάση:τον κανόνα της οκτάδας.
Ο κανόνας της Οκτάδας
Σύμφωνα με τον κανόνα της οκτάδας, τα άτομα προσπαθούν να έχουν ένα πλήρες σύνολο 8 ηλεκτρονίων σθένους. Αυτό συμβαίνει επειδή αυτή η διαμόρφωση παρέχει τη μεγαλύτερη σταθερότητα για το άτομο. Τα ευγενή αέρια της ομάδας 18 έχουν μια οκτάδα ηλεκτρονίων, που τα κάνει να είναι χημικά αδρανή και μη αντιδραστικά. Τα άτομα ευγενών αερίων δεν αντιδρούν με άλλα στοιχεία επειδή είναι ήδη εξαιρετικά σταθερά, λόγω της οκτάδας ηλεκτρονίων που διαθέτουν.
Πώς σχετίζεται ο κανόνας της οκτάδας με την τάση των ενεργειών ιονισμού στον περιοδικό πίνακα; Δεδομένου ότι τα άτομα προσπαθούν να έχουν μια οκτάδα, η ενέργεια ιονισμού κάθε ατόμου διαφέρει ανάλογα με το πόσα ηλεκτρόνια έχει. Ας δούμε αυτή τη σχέση άμεσα με την τάση της ενεργειακής περιόδου ιονισμού.
Τάση περιόδου
Σε μια περίοδο, οι ενέργειες ιονισμού αυξάνονται. Όπως αναφέρθηκε προηγουμένως, τα στοιχεία προσπαθούν να έχουν πλήρεις οκτάδες ηλεκτρονίων σθένους. Καθώς τα στοιχεία έχουν διαδοχικά περισσότερα ηλεκτρόνια σε μια περίοδο, τα άτομα πλησιάζουν όλο και πιο κοντά στον στόχο τους. Έτσι, η αφαίρεση ενός ηλεκτρονίου γίνεται όλο και πιο δύσκολη και η ενέργεια ιοντισμού αυξάνεται, καθώς τα άτομα πλησιάζουν μια οκτάδα. Είναι πολύ εύκολο να αφαιρέσετε ένα ηλεκτρόνιο από ένα άτομο που απέχει πολύ από μια οκτάδα.
Ένα στοιχείο της ομάδας 1 που έχει ένα ηλεκτρόνιο σθένους θα χάσει εύκολα το ηλεκτρόνιό του για να έχει μια οκτάδα ηλεκτρονίων. Έτσι, τα στοιχεία της ομάδας 1 έχουν πολύ χαμηλές ενέργειες ιονισμού. Χρειάζεται πολύ λίγη ενέργεια για να αφαιρεθεί ένα ηλεκτρόνιο επειδή το άτομο μπορεί να είναι πιο σταθερό χωρίς αυτό.
Στο αντίθετο άκρο του φάσματος, τα στοιχεία της ομάδας 17 έχουν πολύ υψηλές ενέργειες ιονισμού. Αυτό συμβαίνει επειδή, με 7 ηλεκτρόνια σθένους, τα αλογόνα θέλουν να κερδίσουν ένα ακόμη ηλεκτρόνιο για να σχηματιστεί μια οκτάδα. Η απώλεια ενός ηλεκτρονίου τους απομακρύνει από τον στόχο τους και, επομένως, χρειάζεται πολύ περισσότερη ενέργεια για να αφαιρεθεί ένα ηλεκτρόνιο.
Τάση ομάδας
Σε μια ομάδα, οι ενέργειες ιονισμού μειώνονται. Αυτό συμβαίνει επειδή καθώς κατεβαίνετε μια ομάδα, τα ηλεκτρόνια βρίσκονται σε διαδοχικά υψηλότερα ενεργειακά επίπεδα, πιο μακριά από την έλξη του πυρήνα. Επιπλέον, σε μια ομάδα, υπάρχουν περισσότερα ηλεκτρόνια μεταξύ των ηλεκτρονίων εξωτερικού σθένους και του πυρήνα. Αυτά τα μεσαία ηλεκτρόνια βοηθούν να «θωρακίσουν» τα εξωτερικά ηλεκτρόνια από τις ελκτικές δυνάμεις του πυρήνα. Επομένως, είναι ευκολότερο να αφαιρέσετε ένα ηλεκτρόνιο από το χαμηλότερο σε μια ομάδα.
Η τάση του περιοδικού πίνακα σε ένα γράφημα

Όπως μπορείτε να δείτε στο γράφημα, τα ευγενή αέρια έχουν τις υψηλότερες ενέργειες ιονισμού και τα αλκαλικά μέταλλα έχουν τις χαμηλότερες ενέργειες ιονισμού. Μεταξύ των ομάδων 1 και 18, τα δυναμικά ιονισμού γενικά αυξάνονται κατά τη διάρκεια μιας περιόδου.
Περαιτέρω ανάγνωση
- Τάση ατομικής ακτίνας
- Τι είναι ένα άτομο
- Τάση ηλεκτροαρνητικότητας
- Εύκολες περιοδικές τάσεις
- Τρόπος ανάγνωσης του περιοδικού πίνακα




