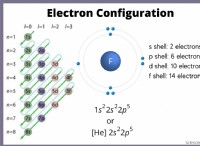
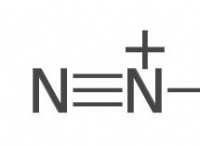
Πώς τα στοιχεία των χημικών αντιδράσεων κατέδειξαν τη θεωρία συγκόλλησης.
1. Στοιχεία από τη στοιχειομετρία αντίδρασης και τον σχηματισμό προϊόντων:
* Σταθερές αναλογίες: Οι χημικές αντιδράσεις εμφανίζονται σε ειδικές, προβλέψιμες αναλογίες. Αυτό υποστηρίζει την ιδέα ότι τα άτομα συνδυάζονται σε σταθερές αναλογίες για να σχηματίσουν μόρια, η οποία αποτελεί τη βάση της θεωρίας συγκόλλησης.
* Σχηματισμός νέων ενώσεων: Οι αντιδράσεις έχουν ως αποτέλεσμα τον σχηματισμό νέων ενώσεων με ξεχωριστές ιδιότητες από τα αντιδραστήρια. Αυτό καταδεικνύει ότι τα άτομα αναδιατάνενται και δεσμεύονται με νέους τρόπους, αλλάζοντας τη δομή και τη συμπεριφορά τους.
* Αλλαγές ενέργειας: Οι χημικές αντιδράσεις συχνά συνοδεύονται από αλλαγές ενέργειας (απελευθέρωση θερμότητας ή απορρόφηση). Αυτό υποδεικνύει ότι τα ομόλογα είναι σπασμένα και σχηματίζονται, με την ενέργεια που απαιτείται για τον σχηματισμό δεσμών να σχετίζεται με τη δύναμη και τον τύπο του δεσμού.
2. Πειραματικές παρατηρήσεις μηχανισμών αντίδρασης:
* Ρύθμιση αντίδρασης: Ο ρυθμός μιας αντίδρασης παρέχει πληροφορίες στη διαδικασία βήμα προς βήμα του σπασίματος και του σχηματισμού των δεσμών. Η παρουσία ενδιάμεσων και μεταβατικών καταστάσεων, οι οποίες είναι ασταθή είδη που σχηματίζονται κατά τη διάρκεια της αντίδρασης, υποστηρίζει περαιτέρω τη δυναμική φύση του σχηματισμού δεσμών.
* στερεοχημεία: Η μελέτη της χωρικής διάταξης των ατόμων σε μόρια (στερεοχημεία) επηρεάζεται σε μεγάλο βαθμό από τη συγκόλληση. Τα προϊόντα αντίδρασης συχνά εμφανίζουν συγκεκριμένες χωρικές ρυθμίσεις, αποκαλύπτοντας τη φύση των συγκροτημάτων των δεσμών.
* φασματοσκοπία: Τεχνικές όπως η φασματοσκοπία υπέρυθρων (IR) και πυρηνικού μαγνητικού συντονισμού (NMR) παρέχουν στοιχεία για τους τύπους των δεσμών και τους δονητικούς τρόπους τους, δίνοντας μια λεπτομερή εικόνα της μοριακής δομής και της σύνδεσης.
3. Θεωρητικές προβλέψεις και επικύρωση:
* Κβαντική μηχανική: Η θεμελίωση της θεωρίας συγκόλλησης είναι η κβαντική μηχανική, η οποία εξηγεί τη συμπεριφορά των ηλεκτρονίων σε άτομα και μόρια. Οι θεωρητικοί υπολογισμοί που βασίζονται σε αυτές τις αρχές μπορούν να προβλέψουν τα μήκη των δεσμών, τις γωνίες δεσμών και τις ενέργειες, οι οποίες στη συνέχεια επικυρώνται με πειραματικές παρατηρήσεις.
* Υπολογιστική Χημεία: Τα προηγμένα προγράμματα υπολογιστών επιτρέπουν την προσομοίωση χημικών αντιδράσεων και την πρόβλεψη προϊόντων αντίδρασης και οδών. Αυτό ενισχύει περαιτέρω τη σχέση μεταξύ θεωρίας και πειράματος.
Παραδείγματα:
* σχηματισμός NaCl: Η αντίδραση του νατρίου (Na) με χλώριο (CL) για να σχηματίσει χλωριούχο νάτριο (NaCl) είναι ένα κλασικό παράδειγμα. Η μεταφορά ενός ηλεκτρονίου από NA σε CL οδηγεί σε ιοντικό δεσμό, αποδεικνύοντας τον τρόπο με τον οποίο οι διαφορετικές ηλεκτροηλεκτρικές ιδιότητες των ατόμων οδηγούν τον σχηματισμό δεσμών.
* Υδρογόνωση αλκενίων: Η προσθήκη αερίου υδρογόνου (Η) σε ένα αλκένιο οδηγεί στο σχηματισμό ενός αλκανίου. Αυτή η αντίδραση αποκαλύπτει το σπάσιμο του διπλού δεσμού στο αλκένιο και τον σχηματισμό νέων μεμονωμένων δεσμών με υδρογόνο, αποδεικνύοντας την ευελιξία του σχηματισμού ομοιοπολικού δεσμού.
Συμπερασματικά, τα στοιχεία των χημικών αντιδράσεων χρησιμεύουν ως ένα ισχυρό εργαλείο για την επικύρωση και τη βελτίωση της θεωρίας συγκόλλησης. Καταδεικνύει ότι τα άτομα συνδυάζονται με συγκεκριμένους τρόπους, σχηματίζοντας νέες ενώσεις με ξεχωριστές ιδιότητες. Επιπλέον, η μελέτη των μηχανισμών αντίδρασης και η εφαρμογή θεωρητικών υπολογισμών παρέχουν λεπτομερή κατανόηση της δυναμικής φύσης των δεσμών και του ρόλου τους στους χημικούς μετασχηματισμούς.