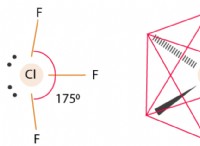
Τι είναι ένα πολυατομικό μόριο και τι μπορείτε να πείτε για τη δομή ηλεκτρονίων σθένους όλων των ατόμων στο μόριο;
πολυατομικά μόρια:περισσότερα από ένα άτομα!
Ένα πολυατομικό μόριο είναι ένα μόριο που αποτελείται από περισσότερα από δύο άτομα , τα οποία συνδέονται ομοιοπολικά. Αυτά τα άτομα μπορούν να είναι του ίδιου στοιχείου (όπως o 2 στο όζον), αλλά πιο συχνά είναι διαφορετικά στοιχεία (όπως h 2 O στο νερό).
δομή ηλεκτρονίων σθένους
Η δομή ηλεκτρονίων σθένους των ατόμων μέσα σε ένα πολυατομικό μόριο είναι ζωτικής σημασίας για την κατανόηση της σύνδεσης και της συνολικής συμπεριφοράς του μορίου. Εδώ μπορούμε να πούμε:
* Τα ηλεκτρόνια σθένους εμπλέκονται στη συγκόλληση: Τα εξώτατα ηλεκτρόνια κάθε ατόμου, γνωστά ως ηλεκτρόνια salence , είναι αυτοί που συμμετέχουν στο σχηματισμό ομοιοπολικών ομολόγων. Αυτά τα ηλεκτρόνια μοιράζονται μεταξύ των ατόμων στο μόριο.
* Κανόνας οκτάδων (κυρίως): Τα άτομα τείνουν να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια για να επιτευχθούν σταθερή διαμόρφωση οκτώ ηλεκτρόνων σθένους, γνωστά ως κανόνας οκτάδας . Αυτός ο κανόνας δεν ακολουθείται πάντοτε αυστηρά, ειδικά για στοιχεία όπως το υδρογόνο (που χρειάζεται δύο ηλεκτρόνια) και τα στοιχεία στην τρίτη σειρά και πέρα από (που μπορούν να φιλοξενήσουν περισσότερα από οκτώ ηλεκτρόνια).
* δομές Lewis: Μπορούμε να αντιπροσωπεύουμε τη δομή ηλεκτρονίων σθένους ενός πολυατομικού μορίου χρησιμοποιώντας δομές Lewis . Αυτά τα διαγράμματα δείχνουν τα άτομα, τους δεσμούς τους και τα μοναδικά ζεύγη ηλεκτρονίων.
* Πόλη και σχήμα: Η κατανομή των ηλεκτρονίων σθένους σε ένα μόριο καθορίζει την πολικότητα και σχήμα . Η ανομοιόμορφη κοινή χρήση ηλεκτρονίων μπορεί να δημιουργήσει πολικούς δεσμούς Μέσα στο μόριο και η συνολική διάταξη των ατόμων και των ηλεκτρονίων μπορεί να οδηγήσει σε διαφορετικές μοριακές γεωμετρίες (γραμμικές, τετραεδρικές, λυγισμένες κλπ.).
Παραδείγματα:
* νερό (h
* Διοξείδιο του άνθρακα (CO
Η κατανόηση της δομής ηλεκτρονίων των ατόμων σε ένα πολυατομικό μόριο είναι το κλειδί για την κατανόηση των χημικών ιδιοτήτων και της συμπεριφοράς του. Αυτή η γνώση μας επιτρέπει να προβλέψουμε πώς τα μόρια θα αντιδράσουν με άλλα μόρια, τη διαλυτότητα τους σε διαφορετικούς διαλύτες και τη συνολική σταθερότητά τους.