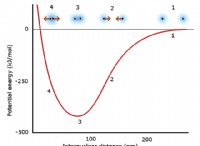
Ποια είναι η σχέση μεταξύ του σημείου τήξης και της ατομικής ακτίνας;
Γενική τάση:
* Μικρή ατομική ακτίνα =υψηλότερο σημείο τήξης. Αυτό οφείλεται στο γεγονός ότι τα μικρότερα άτομα έχουν ισχυρότερες ελκυστικές δυνάμεις μεταξύ των πυρήνων και των ηλεκτρονίων τους. Αυτές οι δυνάμεις ονομάζονται μεταλλικοί δεσμοί σε μέταλλα και δυνάμεις van der waals σε μη μέταλλα. Οι ισχυρότερες δυνάμεις απαιτούν περισσότερη ενέργεια για να ξεπεραστεί, επομένως ένα υψηλότερο σημείο τήξης.
Εξαιρέσεις:
* Ομάδα 1 (αλκαλικά μέταλλα): Παρά την αυξανόμενη ατομική ακτίνα κάτω από την ομάδα, το σημείο τήξης *μειώνεται *. Αυτό οφείλεται στην αποδυνάμωση της μεταλλικής σύνδεσης καθώς το εξωτερικό ηλεκτρόνιο γίνεται πιο χαλαρά και ευκολότερο να αφαιρεθεί.
* Ομάδα 17 (αλογόνα): Παρόμοια με τα αλκαλικά μέταλλα, το σημείο τήξης μειώνεται κάτω από την ομάδα παρά την αυξανόμενη ατομική ακτίνα. Αυτό οφείλεται στο γεγονός ότι η δύναμη των δυνάμεων van der Waals μειώνεται λόγω των ασθενέστερων διαμοριακών αλληλεπιδράσεων.
* Μεταβατικά μέταλλα: Η τάση σημείου τήξης στα μεταβατικά μέταλλα είναι πιο πολύπλοκη και επηρεάζεται από διάφορους παράγοντες, συμπεριλαμβανομένου του αριθμού των μη ζευγαρωμένων ηλεκτρονίων και της δύναμης των μεταλλικών δεσμών.
Άλλοι παράγοντες που επηρεάζουν το σημείο τήξης:
* Τύπος σύνδεσης: Οι ιοντικοί δεσμοί είναι συνήθως ισχυρότεροι από τους ομοιοπολικούς δεσμούς, με αποτέλεσμα υψηλότερα σημεία τήξης.
* Κρυσταλλική δομή: Μια πιο σφιχτά συσκευασμένη κρυσταλλική δομή γενικά οδηγεί σε υψηλότερο σημείο τήξης.
* Πίεση: Η υψηλότερη πίεση μπορεί να αυξήσει το σημείο τήξης.
Συνοπτικά: Ενώ μια μικρότερη ατομική ακτίνα γενικά αντιστοιχεί σε ένα υψηλότερο σημείο τήξης λόγω ισχυρότερων ενδοατομικών δυνάμεων, υπάρχουν εξαιρέσεις λόγω ποικίλων τύπων συγκόλλησης και άλλων παραγόντων.