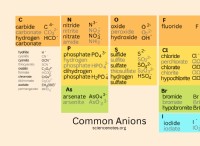
Τι σχηματίζεται τα αλκαλικά μέταλλα όταν αντιδρά με το νερό;
* μεταλλικό υδροξείδιο: Αυτό είναι το κύριο προϊόν της αντίδρασης. Για παράδειγμα, το νάτριο (Na) αντιδρά με νερό για να σχηματίσει υδροξείδιο του νατρίου (NaOH).
* Αέριο υδρογόνου: Η αντίδραση παράγει επίσης αέριο υδρογόνου (H₂), το οποίο είναι εύφλεκτο και μπορεί να αναφλέξει αυθόρμητα την παρουσία αέρα.
* Θερμότητα: Η αντίδραση απελευθερώνει σημαντικές ποσότητες θερμότητας, αρκετά συχνά για να αναφλεγεί το παραγόμενο αέριο υδρογόνου.
Εδώ είναι μια γενική εξίσωση για την αντίδραση:
2M + 2H₂O → 2MOH + H₂
όπου:
* M αντιπροσωπεύει το αλκαλικό μέταλλο
* Το MOH αντιπροσωπεύει το μεταλλικό υδροξείδιο
Σημαντικές σημειώσεις:
* Η αντιδραστικότητα αυξάνεται κάτω από την ομάδα: Το λίθιο (Li) αντιδρά αργά με το νερό, ενώ το νάτριο (Na) αντιδρά πιο έντονα. Το κάλιο (k) αντιδρά ακόμα πιο βίαια και τα βαρύτερα αλκαλικά μέταλλα (RB, CS, FR) αντιδρούν εκρηκτικά.
* Προφυλάξεις ασφαλείας: Οι αντιδράσεις αλκαλικών μετάλλων με νερό είναι εξαιρετικά εξωθερμικές και πρέπει να διεξάγονται με ακραία προσοχή, κατά προτίμηση από έμπειρους χημικούς σε ένα ελεγχόμενο περιβάλλον.