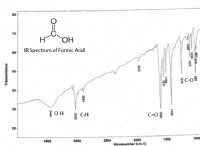
Τι ορίζεται καλύτερα η περιοδικότητα όπως στη χημεία;
Εδώ είναι μια κατανομή:
* Ατομικός αριθμός: Ο αριθμός των πρωτονίων σε έναν πυρήνα του ατόμου, ο οποίος καθορίζει το στοιχείο.
* Διαμόρφωση ηλεκτρονίων: Η διάταξη των ηλεκτρονίων σε διαφορετικά επίπεδα ενέργειας και τροχιακά μέσα σε ένα άτομο.
* Επαναλαμβανόμενο μοτίβο: Καθώς μετακινείτε και κάτω από τον περιοδικό πίνακα, επαναλαμβάνονται οι διαμορφώσεις ηλεκτρονίων, οδηγώντας σε παρόμοιες χημικές και φυσικές ιδιότητες.
Τα βασικά παραδείγματα περιοδικών τάσεων περιλαμβάνουν:
* ενέργεια ιονισμού: Η ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα άτομο. Αυτή η τάση αυξάνεται σε μια περίοδο και μειώνεται κάτω από μια ομάδα.
* Ηλεκτροργατιστικότητα: Την τάση ενός ατόμου να προσελκύει ηλεκτρόνια σε χημικό δεσμό. Αυτή η τάση αυξάνεται σε μια περίοδο και μειώνεται κάτω από μια ομάδα.
* Ατομική ακτίνα: Η απόσταση από τον πυρήνα έως το εξώτατο κέλυφος ηλεκτρονίων. Αυτή η τάση μειώνεται σε μια περίοδο και αυξάνει μια ομάδα.
* Μεταλλικός χαρακτήρας: Την τάση ενός στοιχείου να χάσει ηλεκτρόνια και σχηματισμό κατιόντων. Αυτή η τάση μειώνεται σε μια περίοδο και αυξάνει μια ομάδα.
Η κατανόηση της περιοδικότητας επιτρέπει στους χημικούς να:
* Προβλέψτε τις ιδιότητες των στοιχείων: Η γνώση της θέσης ενός στοιχείου στον περιοδικό πίνακα μας επιτρέπει να εκτιμήσουμε τις ιδιότητές του, ακόμη και αν δεν έχουν προσδιοριστεί πειραματικά.
* Εξηγήστε τη χημική αντιδραστικότητα: Οι περιοδικές τάσεις στην ηλεκτροαρνητικότητα και την ενέργεια ιονισμού βοηθούν στην εξήγηση γιατί τα στοιχεία αντιδρούν μεταξύ τους με ορισμένους τρόπους.
* Σχεδιάστε νέα υλικά: Με την κατανόηση των περιοδικών τάσεων, οι χημικοί μπορούν να σχεδιάσουν υλικά με συγκεκριμένες ιδιότητες για διάφορες εφαρμογές.
Ως εκ τούτου, η περιοδικότητα είναι μια θεμελιώδη έννοια στη χημεία που μας βοηθά να κατανοήσουμε τη συμπεριφορά και τις ιδιότητες των στοιχείων και να προβλέπουν τις αντιδράσεις τους.