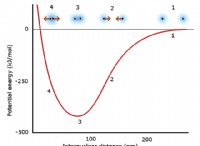
Γιατί τα αέρια είναι τόσο εύκολα συμπιεσμένα, ενώ είναι σχεδόν αδύνατο να συμπιέσουμε ένα στερεό ή υγρό;
αέρια:
* Μεγάλη διαμοριακή απόσταση: Τα μόρια αερίου είναι πολύ μακριά, με αδύναμες ελκυστικές δυνάμεις μεταξύ τους. Αυτό σημαίνει ότι υπάρχει πολύ κενός χώρος μεταξύ τους.
* αδύναμες διαμοριακές δυνάμεις: Οι αδύναμες δυνάμεις (όπως οι δυνάμεις van der Waals) που υπάρχουν μεταξύ των μορίων αερίου ξεπερνούνται εύκολα με εξωτερική πίεση.
* Τυχαία κίνηση: Τα μόρια αερίου κινούνται γρήγορα και τυχαία. Όταν εφαρμόζεται η πίεση, τα μόρια αναγκάζονται πιο κοντά, μειώνοντας τον κενό χώρο μεταξύ τους.
υγρά:
* Συσκευασμένα μόρια: Τα υγρά μόρια είναι πολύ πιο κοντά από τα μόρια αερίου, αλλά μπορούν ακόμα να κινηθούν.
* ισχυρότερες διαμοριακές δυνάμεις: Οι δυνάμεις μεταξύ των υγρών μορίων είναι ισχυρότερες από εκείνες των αερίων, καθιστώντας τα πιο ανθεκτικά στη συμπίεση.
* Περιορισμένη συμπιεστότητα: Όταν εφαρμόζεται η πίεση, τα μόρια πιέζονται πιο κοντά, αλλά οι ισχυρές ενδομοριακές δυνάμεις εμποδίζουν τη σημαντική μείωση του όγκου.
στερεά:
* σταθερές θέσεις: Τα στερεά μόρια είναι σφιχτά συσκευασμένα και σταθεροποιημένα σε συγκεκριμένες θέσεις μέσα σε μια άκαμπτη δομή.
* Ισχυρές διαμοριακές δυνάμεις: Οι διαμοριακές δυνάμεις στα στερεά είναι πολύ ισχυρές, κρατώντας τα μόρια μαζί σε μια σταθερή διάταξη.
* ουσιαστικά ασυμπίεστο: Η εφαρμογή της πίεσης σε ένα στερεό θα προκαλέσει ελαφρώς παραμορφωμένα τα μόρια του, αλλά η άκαμπτη δομή εμποδίζει τη σημαντική μείωση του όγκου.
Συνοπτικά:
Η συμπιεστότητα μιας ουσίας καθορίζεται από την διαμοριακή απόσταση και τη δύναμη των δυνάμεων μεταξύ των μορίων της. Τα αέρια έχουν τη μεγαλύτερη διαμοριακή απόσταση και τις πιο αδύναμες δυνάμεις, καθιστώντας τα εύκολα συμπιεσμένα. Τα υγρά έχουν μικρότερη απόσταση και ισχυρότερες δυνάμεις, καθιστώντας τις λιγότερο συμπιεστές. Τα στερεά έχουν τη μικρότερη απόσταση και τις ισχυρότερες δυνάμεις, καθιστώντας τα ουσιαστικά ασυμπίεστά.