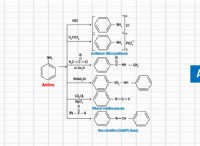
Γιατί το ακετανίλιο του Para-Nitro είναι αδιάλυτο στο νερό ενώ το ορθο-νιτροί διαλυτό νερό;
Κατανόηση της διαλυτότητας
Η διαλυτότητα εξαρτάται από δύο κύριους παράγοντες:
* Διαμοριακές δυνάμεις: Η αντοχή των αξιοθέατων μεταξύ των μορίων διαλυτής ουσίας και των μορίων διαλύτη.
* πολικότητα: Το αν ένα μόριο είναι πολικό (έχοντας ανομοιόμορφη κατανομή φορτίου) ή μη πολική (έχοντας ακόμη και κατανομή φόρτισης).
Ανάλυση των μορίων
* para-nitroacetanilide:
* Η ομάδα Nitro (-no₂) είναι η πυκνότητα ηλεκτρονίων, τραβώντας την πυκνότητα ηλεκτρονίων μακριά από το υπόλοιπο μόριο.
* Η θέση του para (απέναντι από την ομάδα αμιδίου) καθιστά το φαινόμενο που απομακρύνεται από το ηλεκτρόνιο πιο έντονο.
* Αυτό έχει ως αποτέλεσμα ένα πιο nonpolar μόριο σε σύγκριση με το ορθογυτικό του.
* Ορθο-νιτροακετανίλιδο:
* Ο όμιλος Nitro εξακολουθεί να είναι ηλεκτρονική-μελαγχολική, αλλά η εγγύτητά του με την ομάδα αμιδίου (-nhcoch₃) δημιουργεί μια ισχυρότερη αλληλεπίδραση διπολικής διπόλης . Αυτό έχει ως αποτέλεσμα ένα περισσότερο πολικό μόριο.
Διαλυτότητα σε νερό
* Το νερό είναι ένας πολικός διαλύτης. Σχηματίζει ισχυρούς δεσμούς υδρογόνου.
* Τα πολικά μόρια διαλύονται καλύτερα σε πολικούς διαλύτες λόγω ευνοϊκών αλληλεπιδράσεων.
* Τα μη πολικά μόρια διαλύονται καλύτερα σε μη πολικούς διαλύτες (όπως το λάδι).
Επεξήγηση της διαφοράς διαλυτότητας
* para-nitroacetanilide: Λόγω της μη πολικής φύσης του, έχει ασθενέστερες αλληλεπιδράσεις με μόρια νερού και επομένως είναι αδιάλυτο .
* Ορθο-νιτροακετανίλιδο: Η υψηλότερη πολικότητα του επιτρέπει να σχηματίζει ισχυρότερους δεσμούς υδρογόνου με μόρια νερού, καθιστώντας το διαλυτή .
Συνοπτικά
Η διαφορά στη διαλυτότητα μεταξύ παρα-νιτροακετανλίδης και ορθο-νιτροακετανιλιδίου προκύπτει από την επίδραση της θέσης της ομάδας νιτρο στην πολικότητα του μορίου. Το ισομερές para είναι πιο μη πολικό και επομένως λιγότερο διαλυτό στο νερό, ενώ το ορθο ισομερές είναι πιο πολικό και επομένως πιο διαλυτό.