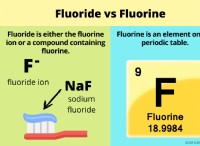
Όταν περισσότερα ηλεκτρόνια σθένους μετάλλου είναι κοινό σημείο τήξης τείνει να είναι;
* Μεταλλική σύνδεση: Τα μέταλλα αποτελούν έναν μοναδικό τύπο σύνδεσης που ονομάζεται μεταλλική σύνδεση. Σε αυτή τη συγκόλληση, τα ηλεκτρόνια σθένους απομακρύνονται, πράγμα που σημαίνει ότι δεν συνδέονται με κανένα συγκεκριμένο άτομο, αλλά μάλλον μετακινούνται ελεύθερα σε ολόκληρη τη μεταλλική δομή.
* Ισχυρότερα ομόλογα: Τα περισσότερα ηλεκτρόνια σθένους ένα μεταλλικό άτομο συμβάλλει σε αυτή τη "θάλασσα των ηλεκτρονίων", τόσο ισχυρότερη γίνεται η μεταλλική συγκόλληση. Σκεφτείτε το σαν να έχετε περισσότερη κόλλα που κρατά τα μέταλλα άτομα μαζί.
* Υψηλό σημείο τήξης: Οι ισχυρότεροι δεσμοί απαιτούν περισσότερη ενέργεια για να σπάσει. Αυτό σημαίνει ότι τα μέταλλα με περισσότερα ηλεκτρόνια σθένους θα έχουν υψηλότερα σημεία τήξης, επειδή απαιτείται περισσότερη ενέργεια για να ξεπεραστούν οι ισχυρές ελκυστικές δυνάμεις που κρατούν τα άτομα μαζί.
Παράδειγμα:
* Το νάτριο (Na) έχει ένα ηλεκτρόνιο σθένους και λιώνει στους 98 ° C.
* Το μαγνήσιο (mg) έχει δύο ηλεκτρόνια σθένους και λιώνει στους 650 ° C.
* Το αλουμίνιο (AL) έχει τρία ηλεκτρόνια σθένους και λιώνει στους 660 ° C.
Σημαντική σημείωση: Ενώ ο αριθμός των ηλεκτρονίων σθένους είναι ένας βασικός παράγοντας, άλλοι παράγοντες επηρεάζουν επίσης το σημείο τήξης, όπως:
* Ατομικό μέγεθος: Τα μικρότερα άτομα έχουν γενικά υψηλότερα σημεία τήξης, επειδή τα ηλεκτρόνια τους είναι πιο κοντά στον πυρήνα και επομένως πιο στενά συνδεδεμένα.
* Κρυσταλλική δομή: Η διάταξη των ατόμων στο κρυσταλλικό πλέγμα του μετάλλου επηρεάζει επίσης το σημείο τήξης του.
Επιτρέψτε μου να ξέρω αν θέλετε να εξερευνήσετε οποιονδήποτε από αυτούς τους παράγοντες με περισσότερες λεπτομέρειες!