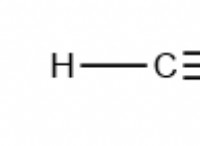
Πώς θα μπορούσαν τα καθένα που αντιδρούν τα άτομα για να επιτύχει μια διαμόρφωση ευγενών αερίου;
Κατανόηση ευγενών αερίων
Τα ευγενή αέρια (He, NE, AR, KR, XE, RN) είναι απίστευτα σταθερά στοιχεία. Αυτή η σταθερότητα προέρχεται από το να έχει ένα πλήρες εξωτερικό κέλυφος ηλεκτρονίων (επίσης γνωστό ως κέλυφος σθένους). Ένα πλήρες εξωτερικό κέλυφος σημαίνει ότι έχουν χαμηλή τάση να κερδίζουν ή να χάνουν ηλεκτρόνια, καθιστώντας τα μη αντιδραστικά τους.
Ο κανόνας οκτάδων
Ο κανόνας οκτάδων είναι μια κατευθυντήρια γραμμή που τα κράτη που δηλώνουν τα άτομα τείνουν να κερδίζουν, να χάνουν ή να μοιράζονται ηλεκτρόνια για να επιτύχουν μια σταθερή διαμόρφωση με οκτώ ηλεκτρόνια στο εξωτερικό τους κέλυφος, μιμώντας τη διαμόρφωση ηλεκτρονίων των ευγενών αερίων.
Τύποι αντιδράσεων
Τα άτομα επιτυγχάνουν ευγενείς διαμορφώσεις αερίου μέσω διαφορετικών τύπων χημικής σύνδεσης:
* Ιονική σύνδεση: Περιλαμβάνει τη μεταφορά ηλεκτρονίων από το ένα άτομο στο άλλο, με αποτέλεσμα το σχηματισμό ιόντων με αντίθετες χρεώσεις.
* Παράδειγμα: Το νάτριο (Na) χάνει ένα ηλεκτρόνιο για να γίνει Na+ (κατιόν), επιτυγχάνοντας μια διαμόρφωση νέον. Το χλώριο (CL) κερδίζει ένα ηλεκτρόνιο για να γίνει cl- (ανιόν), επιτυγχάνοντας μια διαμόρφωση αργού. Στη συνέχεια προσελκύουν ο ένας τον άλλον, σχηματίζοντας την ιοντική ένωση NaCl (χλωριούχο νάτριο).
* ομοιοπολική σύνδεση: Περιλαμβάνει την ανταλλαγή ηλεκτρονίων μεταξύ των ατόμων.
* Παράδειγμα: Το οξυγόνο (O) χρειάζεται δύο ακόμη ηλεκτρόνια για να επιτύχει μια διαμόρφωση νέον. Μοιράζοντας δύο ηλεκτρόνια με ένα άλλο άτομο οξυγόνου, και οι δύο επιτυγχάνουν μια σταθερή διαμόρφωση. Αυτό σχηματίζει ένα διατομικό μόριο, O2.
* Μεταλλική σύνδεση: Εμφανίζεται σε μέταλλα, όπου τα ηλεκτρόνια απομακρύνονται και κινούνται ελεύθερα σε όλη τη δομή. Αυτό οδηγεί σε μια κοινή "θάλασσα ηλεκτρονίων" και οδηγεί σε μια ευγενή διαμόρφωση αερίου για όλα τα μεταλλικά άτομα.
Ειδικά παραδείγματα:
* νάτριο (NA): Χάνει ένα ηλεκτρόνιο για να σχηματίσει Na+ (κατιόν), επιτυγχάνοντας μια διαμόρφωση νέον.
* χλώριο (CL): Κερδίζει ένα ηλεκτρόνιο για να σχηματίσει CL- (ανιόν), επιτυγχάνοντας μια διαμόρφωση αργού.
* μαγνήσιο (mg): Χάνει δύο ηλεκτρόνια για να σχηματίσουν Mg2+ (κατιόν), επιτυγχάνοντας μια διαμόρφωση νέον.
* οξυγόνο (o): Κερδίζει δύο ηλεκτρόνια για να σχηματίσουν O2- (ανιόν), επιτυγχάνοντας μια διαμόρφωση νέον.
* άνθρακα (c): Μοιράζεται τέσσερα ηλεκτρόνια με άλλα άτομα για την επίτευξη μιας διαμόρφωσης ευγενών αερίου. Για παράδειγμα, στο μεθάνιο (CH4), ο Carbon μοιράζεται τέσσερα ηλεκτρόνια με τέσσερα άτομα υδρογόνου, με αποτέλεσμα μια σταθερή διαμόρφωση.
Βασικά σημεία:
* Τα άτομα προσπαθούν για μια σταθερή διαμόρφωση, κερδίζοντας, χάνοντας ή μοιράζοντας ηλεκτρόνια για να επιτύχουν ένα πλήρες εξωτερικό κέλυφος, μιμώντας τα ευγενή αέρια.
* Η ιοντική συγκόλληση περιλαμβάνει μεταφορά ηλεκτρονίων, ενώ η ομοιοπολική συγκόλληση περιλαμβάνει την κατανομή ηλεκτρονίων.
* Ο μεταλλικός δεσμός δημιουργεί μια θάλασσα ηλεκτρονίων, παρέχοντας μια σταθερή διαμόρφωση για τα μεταλλικά άτομα.
Επιτρέψτε μου να ξέρω αν θέλετε να εξερευνήσετε τη διαμόρφωση ηλεκτρονίων συγκεκριμένων στοιχείων ή αντιδράσεων!