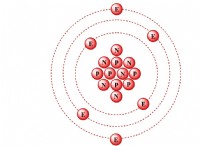
Πώς σχηματίζουν τα ηλεκτρονικά και τα δεσμούς κατιόντων ανιόντων;
1. Ανιόντα και κατιόντα:
* Anions: Αρνητικά φορτισμένα ιόντα. Κερδίζουν ηλεκτρόνια, αυξάνοντας τον αριθμό των ηλεκτρονίων τους και τους δίνοντάς τους αρνητικό φορτίο.
* ΚΟΟΔΙΑ: Θετικά φορτισμένα ιόντα. Χάνουν ηλεκτρόνια, μειώνοντας τον αριθμό των ηλεκτρονίων τους και οδηγούν σε θετικό φορτίο.
2. Η μεταφορά ηλεκτρονίων:
* Ένας ιοντικός δεσμός σχηματίζεται όταν ένα άτομο μετάλλου (το οποίο τείνει να χάσει ηλεκτρόνια) αλληλεπιδρά με ένα μη μέταλλο άτομο (το οποίο τείνει να κερδίζει ηλεκτρόνια).
* Το μεταλλικό άτομο χάνει ένα ή περισσότερα ηλεκτρόνια, καθιστώντας θετικά φορτισμένο κατιόν.
* Το μη μεταλλικό άτομο κερδίζει αυτά τα χαμένα ηλεκτρόνια, καθιστώντας ένα αρνητικά φορτισμένο ανιόν.
3. Ηλεκτροστατική έλξη:
* Τα αντίθετα φορτισμένα ιόντα (κατιόν και ανιόν) προσελκύονται μεταξύ τους λόγω ηλεκτροστατικών δυνάμεων. Αυτό το αξιοθέατο είναι ο ιοντικός δεσμός.
* Αυτή η ισχυρή έλξη συγκρατεί τα ιόντα μαζί σε μια άκαμπτη, κρυσταλλική δομή.
Παράδειγμα:σχηματισμός χλωριούχου νατρίου (NaCl):
1. νάτριο (na) , ένα μέταλλο, έχει ένα ηλεκτρόνιο στο εξωτερικό του κέλυφος.
2. Χλώριο (CL) , ένα μη μέταλλο, έχει επτά ηλεκτρόνια στο εξωτερικό κέλυφος του.
3. Το νάτριο χάνει το εξώτατο ηλεκτρόνιο του για να γίνει ένα θετικά φορτισμένο ιόν νατρίου (Na⁺).
4. Χλωρίνη κερδίζει αυτό το ηλεκτρόνιο για να γίνει ένα αρνητικά φορτισμένο ιόν χλωριούχου (CL⁻).
5. Η ηλεκτροστατική έλξη μεταξύ Na⁺ και CL⁻ σχηματίζει τον ιοντικό δεσμό, δημιουργώντας το χλωριούχο ένωση νατρίου (NaCl).
Βασικά σημεία:
* Οι ιοντικοί δεσμοί σχηματίζονται συνήθως μεταξύ μετάλλων και μη μεταλλικών.
* Η μεταφορά ηλεκτρονίων οδηγεί σε πλήρη μεταφορά φορτίου.
* Τα προκύπτοντα ιόντα συγκρατούνται από ισχυρές ηλεκτροστατικές δυνάμεις.
* Οι ιοντικές ενώσεις είναι συνήθως στερεές σε θερμοκρασία δωματίου και έχουν υψηλά σημεία τήξης.
Επιτρέψτε μου να ξέρω αν θέλετε μια πιο εμπεριστατωμένη εξήγηση για οποιαδήποτε από αυτές τις έννοιες.