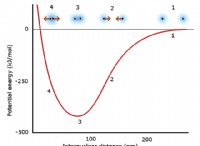
Μπορείτε να αυξήσετε τον αριθμό των σωματιδίων μια ουσία στη χημική αντίδραση;
* Διατήρηση της μάζας: Η θεμελιώδης αρχή της χημείας δηλώνει ότι δεν μπορεί να δημιουργηθεί ή να καταστραφεί σε χημική αντίδραση. Αυτό είναι γνωστό ως ο νόμος της διατήρησης της μάζας.
* ATOMS TERRANGE: Οι χημικές αντιδράσεις περιλαμβάνουν το σπάσιμο και τη διαμόρφωση χημικών δεσμών μεταξύ των ατόμων. Τα ίδια τα άτομα δεν δημιουργούνται ή καταστρέφονται, απλώς αναδιαμορφώνουν για να σχηματίσουν νέα μόρια.
Τι μπορείτε να κάνετε:
* Αυξήστε την ποσότητα ουσίας: Μπορείτε να προσθέσετε περισσότερα από τα αντιδραστήρια για να αυξήσετε τον συνολικό αριθμό σωματιδίων που εμπλέκονται στην αντίδραση. Αυτό θα οδηγήσει στη διαμόρφωση περισσότερου προϊόντος, αλλά δεν θα αλλάξει τον αριθμό των σωματιδίων ανά μονάδα της αρχικής ουσίας.
* Πυρηνικές αντιδράσεις: Οι πυρηνικές αντιδράσεις περιλαμβάνουν αλλαγές στον πυρήνα των ατόμων και μπορούν να οδηγήσουν στη δημιουργία ή την καταστροφή των ατόμων. Ωστόσο, αυτές δεν είναι τυπικές χημικές αντιδράσεις.
Παράδειγμα:
Φανταστείτε μια αντίδραση όπου το αέριο υδρογόνου (H₂) αντιδρά με αέριο οξυγόνου (O₂) για να σχηματίσει νερό (H₂O).
* Αντιδραστήρια: 2 μόρια υδρογόνου (4 άτομα υδρογόνου) + 1 μόριο οξυγόνου (2 άτομα οξυγόνου)
* Προϊόν: 2 μόρια νερού (4 άτομα υδρογόνου + 2 άτομα οξυγόνου)
Παρατηρήστε ότι ο συνολικός αριθμός των ατόμων παραμένει ο ίδιος και στις δύο πλευρές της εξίσωσης. Τα άτομα έχουν απλώς αναδιαμορφωθεί για να σχηματίσουν νέα μόρια.
Επιτρέψτε μου να ξέρω αν έχετε άλλες ερωτήσεις σχετικά με τις χημικές αντιδράσεις!